一、选择题:本题共 16 题,共 44 分。第 1~10 题,每小题 2 分;第 11~16 题,每小题 4 分。每小题给出的四个选项中,只有一项是符合题目要求的。
-
A . 过度开荒伐木,促进制造业发展
B . 积极研发推广风能、水能等,减少碳排放
C . 注重饮食卫生,大量使用一次性木筷、饭盒
D . 为节约成本,碎玻璃、废旧电池等生活垃圾无需分类
-
A . 裂化汽油
B . 煤
C . 石油
D . 天然气
-
A . 两代“四羊方尊”属于青铜制品,青铜是一种铜合金,合金的熔点比金属铜熔点高
B . 侯氏制碱法中用到了 NaHCO3 溶解度相对较大这一性质
C . “世间丝、麻、裘皆具素质……”,这里丝、麻、裘主要成分是蛋白质
D . 西晋·刘琨:“何意百炼钢,化为绕指柔” ,炼铁和炼钢都发生了氧化还原反应
-
A . 三峡大坝的建设使用了大量的水泥,水泥属于硅酸盐材料
B . 钛合金密度小、硬度大、熔点高、耐腐蚀,可用于制造飞机、火箭
C . 碳纳米管是一种含有碳元素的化合物,属于新型无机非金属材料
D . 碳化钛陶瓷(主要成分 TiC)具有金属光泽、很硬、高熔点、有导热性和导电性,故表现了一些金属性质。
-
A . 葡萄酒中添加过量的二氧化硫可以起到杀菌、抗氧化、改变果香味的作用
B . 液氨汽化时会吸收大量的热,NH3 可用作制冷剂
C . 某雨水样品放置一段时间后 pH 变小,是因为溶有二氧化碳
D . 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮
-
6.
(2023高一下·龙华期中)
下列实验方案中,实验装置正确且能达到实验目的的是( )
|
选项
|
A
|
B
|
C
|
D
|
|
实验
装置
|

|

|

|

|
|
实验
目的
|
两个都能做喷泉实验
|
制备乙酸乙酯
|
收集NO2
并处理尾气
|
稀释浓硫酸
|
A . A
B . B
C . C
D . D
-
A . 大量的金属钠密封于铁桶内,少量金属钠保可存在煤油中
B . 浓硝酸保存在棕色玻璃试剂瓶中
C . 可用如右图装置暂时储存 NO 气体,以备后续实验使用
D . 氢氧化钠溶液、新制氯水保存在有橡皮塞的玻璃瓶中
-
8.
(2023高一下·龙华期中)
下列化工原理生产中错误的是( )
①可以用电解熔融氯化钠的方法来制取金属钠
②可以用钠加入氯化镁的饱和溶液中制取金属镁
③用电解法冶炼铝时,原料是氯化铝
④对一些不活泼的金属,可以用加热法制备
A . ②③
B . ①③
C . ①②③
D . ②③④
-
A . 葡萄糖在酶作用下分解生成乙醇和二氧化碳
B . 检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2 悬浊液,加热,观察 是否出现砖红色沉淀
C . 煤的气化和液化是物理变化,是高效、清洁地利用煤的重要途径
D . 蛋白质在紫外线、CuSO4 溶液、冷藏等作用下均会发生变性
-
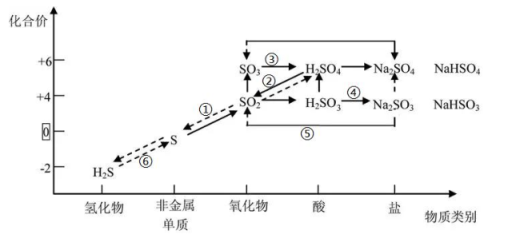
A . SO2 通入氨水中,和转化④有相似原理,也可生成正盐或酸式盐
B . 实验室可用转化⑤制备 SO2 , 也可以让转化①和⑥在同一容器里同时发生
C . 转化②可以是 Cu+2H2SO4(浓)=SO2↑+CuSO4+2H2O
D . 转化③易发生,其逆过程相对难发生
-
A . CH3CH3 和 CH3CH2CH3是同系物,CH3(CH2)4CH3和 CH3CH2CH2CH(CH3)2也是同系物
B . 按分子中碳原子的价键是否被氢原子“饱和”,将烯烃、炔烃等列为不饱和烃;苯等芳香烃属于环状烃,列为饱和烃
C . 聚丙烯的结构简式可写为 D . 分子式为 C3H8、C4H10、C5H12 代表的物质分别有一种、两种、三种
D . 分子式为 C3H8、C4H10、C5H12 代表的物质分别有一种、两种、三种
-
A . 向 Fe(NO3)2 溶液中滴加稀盐酸,无明显的变化
B . 加入烧碱溶液后加热,产生能使湿润红色石蕊试纸变蓝的气体,则原溶液中一定有 NH4+
C . 混入适量空气,用 NaOH 溶液可以除去尾气中的氮氧化物
D . 浓硫酸滴到纸张上变黑,说明浓硫酸具有脱水性
-
13.
(2023高一下·龙华期中)
二氧化硫一定条件下可以发生如下两反应,下列说法正确的是( )
①SO2+Cl2=SO2Cl2(无色液体)
②SO2+Cl2+2H2O=2HCl+H2SO4
A . 两反应都将有色物变无色物,表现 SO2 的漂白性
B . 反应②中生成了 Cl- , 中子数为 20 的氯离子可表示为 Cl-
C . a mol SO2发生了反应①,b mol SO2发生了反应②,a+b=2 时两反应总共转移 4mol 电子
D . 二氧化硫一定条件下也可以被浓 H2SO4氧化
Cl-
C . a mol SO2发生了反应①,b mol SO2发生了反应②,a+b=2 时两反应总共转移 4mol 电子
D . 二氧化硫一定条件下也可以被浓 H2SO4氧化
-
14.
(2023高一下·龙华期中)
将 100mL 甲烷与一定量的氯气混合于大试管中,并将试管倒立于盛有饱和 NaCl溶液的水槽中(如图所示),对于此反应,下列有关叙述不正确的是( )
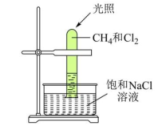
A . 饱和 NaCl溶液可以降低氯气溶解度,减少氯气损失
B . 氯气小于 100mL 时,生成的产物几乎是 CH3Cl 和 HCl
C . 试管内有少量白雾
D . 该反应的现象有试管内气体颜色变浅和试管内壁产生油状液滴等
-
A . 1 molN2O4 被完全还原为 N2转移的电子数为 4NA
B . 5.6 g Fe 和 6.4g Cu 分别与足量的 S 完全反应,转移电子数均为 0.2NA
C . 将 0.1 mol NaClO 固体投入足量浓盐酸中,转移电子数为 0.1NA
D . 由乙烯和环丙烷(C3H6)组成的 28g 混合气体中含有 3NA 个氢原子
-
A . 灼烧海带时用到的玻璃仪器有:酒精灯、坩埚、泥三角等
B . 向含 I- 溶液中加入 H2O2和稀硫酸时发生反应:2I-+H2O2+2H+ =I2+2H2O
C . 步骤①是过滤,步骤②是蒸馏,灼烧时主要发生分解反应
D . 碘易溶于乙醇,提取碘时可用乙醇作萃取剂
二、非选择题:共 4 题,共 56 分。均为必做题,考生都必须作答。
-
-
(1)
仪器 A、B 的名称分别是;实验前,先将仪器按图连接好装置 1,然后,再加药品之后开始实验。
-
(2)
实验室常用装置 2 制备氨气。写出装置2中反应的化学反应方程式。
-
(3)
用装置 1 进行一段时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,仪器B 内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的 N2。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:。
-
(4)
写出洗气瓶中浓硫酸发挥作用的化学反应方程式。
-
(5)
装置 3 是装置 1 的局部。用装置 3,从左端通入 CH3CH2OH 蒸气,产生和上述通入 NH3实验相似的现象(如,黑色氧化铜粉末转为红色,仪器 B 内出现蓝色)之外,仪器 B 内有液化的物质 X,右端出气导管口有 X 的刺激性气味。物质 X 是。
-
(6)
将产生的 NH3 和 NO2的一定条件下混和完全反应,生成了 2.8g N2和一定量的 H2O。这 2.8gN2中氧化产物和还原产物的物质的量之比为。
-
-
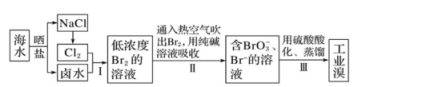
(1)
步骤Ⅱ将溴单质又转化成溴的化合物,目的是富集溴元素。已知某海水中的溴元素含量为60mg/L,取 1000L 的海水,富集后获得 2L 溶液,溴元素(以总原子计算)浓度为 0.3mol/L,至此,海水中有% 的溴被提取。
-
(2)
配平步骤Ⅱ中涉及的离子反应:
Br2+ CO =BrO3-+ Br-+ CO2↑
=BrO3-+ Br-+ CO2↑
-
(3)
上述富集过程也可以先用的水溶液吸收,再用物质氧化,然后蒸馏。
-
(4)
步骤Ⅰ之前,用硫酸酸化的目的主要是除去海水中如碳酸根等有害物,并抑制 Cl2、Br2与水的反应等。写出 Cl2和水反应的离子方程式。
-
(5)
以下是从海水中提取镁的某工业流程:

这个流程中的化合反应有个。取过量的镁与含 0.2mol H2SO4 的浓硫酸反应,转移电子数(填“小于”、 “大于”或 “等于”)0.2mol。
-
19.
(2023高一下·龙华期中)
某工业生产,从铝土矿(主要成分是 Al
2O
3 ,还有 SiO
2、Fe
2O
3等杂质)中提取氧化铝并制备氮化铝,流程如图:
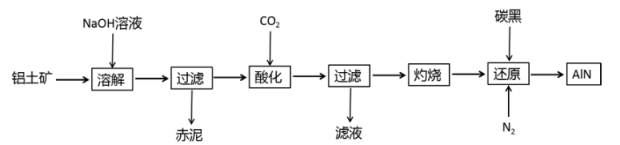
-
-
-
(3)
“灼烧”时化学反应类型是;“还原”时,被还原的元素是。
-
(4)
工业制硫酸简图如下:

其中从沸腾炉反应出来的 SO2 “净化”是指依次进行“除尘、洗涤、”。已知吸收塔里用浓硫酸吸收溶解 SO3 , 得到的发烟硫酸再与适量的水作用获得一定浓度的硫酸,推测除去SO2 中的 SO3 杂质,下面可选择的试剂是(填字母)
A.饱和的 NaHSO3 溶液
B.浓硫酸
C.热的稀硫酸
D.热水
-
-
-
-
(3)
下列说法正确的是____。
A . 物质 A 属于不饱和烃、也属于链状烃
B . 可利用转化①,除去 CH4中的杂质 C2H4
C . 与物质 C 同类别的同分异构体还有 3 种
D . 物质 E 可能是一种塑料
-
-
(5)
①~④四个转化中,原子利用率可能达到 100%的有。
-
(6)
实验室可实现转化⑤获得乙酸乙酯,在反应容器中加入物质的顺序是:先加入 3mL然后边振荡边慢慢加入 2mL和 2mL 第三种物质。
-
(7)
CH4分子中去掉 1 个氢原子是甲基(-CH3),C2H6分子中去掉 1 个氢原子是乙基(-CH2CH3),写出 C3H8 分子中去掉 1 个氢原子得到的基团的结构简式:



=BrO3-+ Br-+ CO2↑



