 D . 氯化钙的电子式:
D . 氯化钙的电子式:|
|
|
|
|
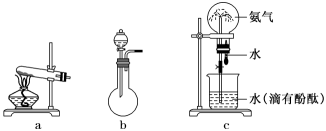
| A.检验氨气极易溶于水 | B.制取并干燥氨气 | C.制取并收集二氧化硫 | D.将化学能转化为电能 |
 C .
C . 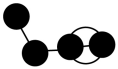 D .
D . 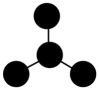


| 选项 | 实验事实 | 结论 |
| A | NH3 的水溶液可以导电 | NH3是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | 浓硝酸久置发黄 | 硝酸不稳定 |
| D | 浓硫酸能使蓝色胆矾晶体变成白色 | 浓硫酸具有脱水性 |

|
选项 |
实验操作和和现象 |
结论 |
|
A |
某溶液中加入浓NaOH溶液,微热,试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 |
溶液中含NH |
|
B |
将两支分别蘸有浓氨水和浓盐酸的玻璃棒接近,中间出现白烟现象 |
浓氨水和浓盐酸都具有挥发性 |
|
C |
除去粗盐中Ca2+、Mg2+、 |
盐酸已滴加至完全反应的标准 |
|
D |
某溶液中滴加BaCl2溶液,出现白色沉淀,再加足量稀HCl,沉淀不溶解 |
溶液中含有 |
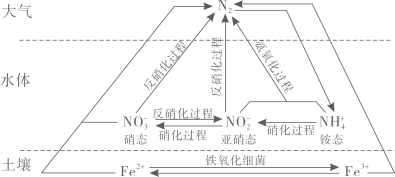
 的名称为异丁烷
B . CH3CH2CH2CH2CH3和
的名称为异丁烷
B . CH3CH2CH2CH2CH3和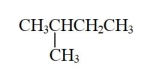 互为同素异形体
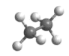
C .
互为同素异形体
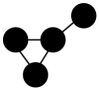
C . 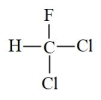 和
和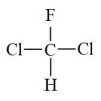 为同一物质
D . CH3CH2OH和CH3OCH3互为同系物
为同一物质
D . CH3CH2OH和CH3OCH3互为同系物
 B .
B . 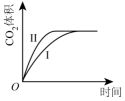 C .
C . 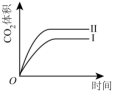 D .
D . 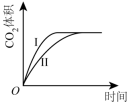



请将能得出对应结论的实验现象填入表中。
| 验证气体 | 实验现象 | 实验结论 |
| SO2 |
| 有SO2产生 |
| CO2 |
| 有CO2产生 |
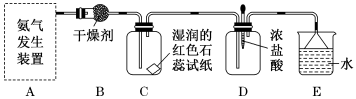
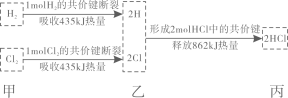
①的化学方程为。
②的化学方程式为。
③列举两种不同类别的将HNO3转化为NH4NO3的化合物M:、。

沉淀A的主要成分是、(填化学式)。
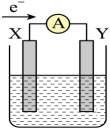
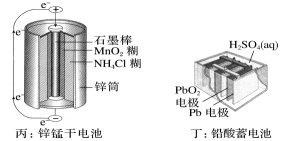
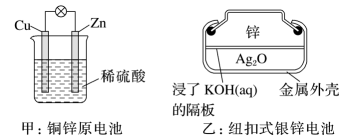
下列装置中能够实现化学能转化为电能的是(填字母)。


①电极d是(填“正极”或“负极”);
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为L。
| 化学键 | H—H | O=O | O—H |
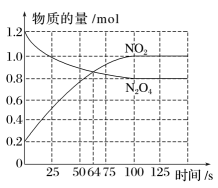
| E/(kJ·mol-1) | 436 | x | 463 |

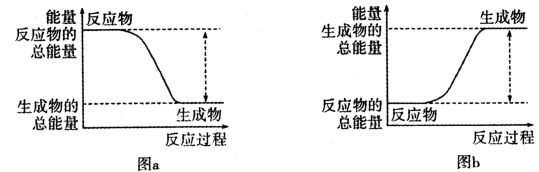
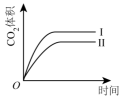
曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
①计算当反应生成1.5molCH3OH(g)时,能量变化值是kJ。
②推测反应CH3OH(g)⇌CO(g)+2H2(g)是(填“吸热”或“放热”)反应。
| 时间 | 0 min | 3 min | 6 min | 9 min | 12 min |
| n(CH3OH) | 0 mol | 0.50 mol | 0.65 mol | 0.75 mol | 0.75 mol |
| n(CO2) | 1 mol | 0.50 mol | 0.35 mol | a | 0.25 mol |
①上表中,a为mol。
②由表可知,3~6 min内,v(CO2)=mol·L-1·min-1。
③对于上述反应,下列叙述正确的是。
A.当各气体的浓度不再改变时,该反应一定已达平衡状态。
B.当该反应达到平衡后,。
C.由表可知,3 min时CH3OH的生成速率大于12 min时CH3OH的分解速率。