

| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 用精密pH试纸分别测定相同浓度NaClO和 | pH: | 酸性强弱: |
| B | 向盛有2.0 mL甲苯的试管中加入3滴酸性 | 紫色褪去 | 甲苯中含有碳碳双键,可被酸性 |
| C | 取5 mL 0.1 mol KI溶液于试管中,加入1 mL 0.1 mol•L | 溶液变血红色 | KI与 |
| D | 向盛有2 mL 0.1 mol/L NaOH溶液的试管中滴加4~5滴0.1 mol/L | 先生成白色沉淀,后生成蓝色沉淀 | 说明 |
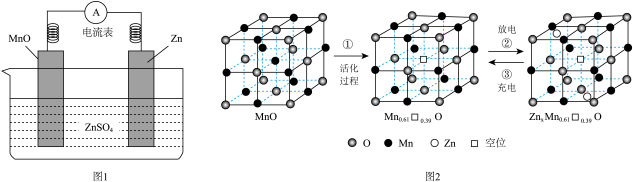
已知:晶体中某结点上的原子空缺了,则称为空位。

| 实验猜想:猜想a: | |
| 实验方案 | |
| 方案1 | 配制饱和 |
| 方案2 | 取适量Cu与浓 |
| 方案3 | 加热该绿色溶液,观察溶液颜色 |
| 资料卡片:① | |
下列说法不正确的是( )

尿素三聚氰酸二氯异氰尿酸钠
已知:实验室常用高浓度的NaClO溶液和固体,在10℃时反应制备二氧异氰尿酸钠,主要发生反应:
。
①NaClO溶液可由低温下将缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为;
②为提高B中NaOH的利用率,需对该装置进行改进的可行方法是(一种即可)。
待装置B中出现液面上方有黄绿色气体现象时,可由三颈烧瓶进料口加入固体,反应过程中仍需不断通入
的理由是。实验过程中若温度过高,pH值过低,会生成
, 写出
与
生成
、
的化学方程式:。
准确称取m g样品,配成100 mL溶液,取20.00 mL所配溶液于碘量瓶中,加入稀和过量KI溶液,充分反应后,加入淀粉溶液,用c mol⋅L
标准溶液滴定,滴到终点时,消耗
标准溶液的体积为V mL,则样品有效氯含量为%(有效氯含量
)。
反应Ⅰ:
反应Ⅱ:
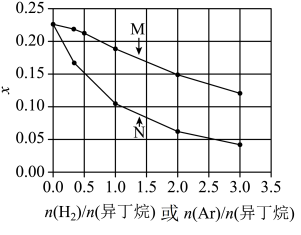
①其中为曲线。
②平衡时异丁烷摩尔分数x随的增大而减小,其原因为。
ⅰ.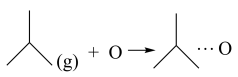
ⅱ.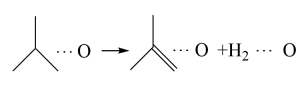
ⅲ.
ⅳ.

已知:①浸出液中含有的金属离子主要有、
、
、
。
②氧化性。
③、
、
、
。溶液中金属离子物质的量浓度低于
mol/L时,可认为沉淀完全。
②写出除杂过程中参与反应的化学方程式。
③调pH过程中加调节后会生成两种沉淀,同时得到的滤液中
mol/L,调节pH的范围为。


 的反应类型为。
的反应类型为。
 生成A的化学反应方程式为。
生成A的化学反应方程式为。
 为原料合成E的化学反应方程式。
为原料合成E的化学反应方程式。
 分子中最多有个原子共面。
分子中最多有个原子共面。
![]()