①在空气中长时间放置少量金属钠,最终的产物是Na2CO3
②人们使用次氯酸盐代替氯水作为漂白剂,因为次氯酸盐的漂白性更强
③根据是否有丁达尔现象将分散系分为溶液、胶体和浊液
④在生产、生活中,铝合金是用量最大、用途最广的合金材料
⑤H2O的沸点比H2S的沸点高是因为H2O的分子间存在氢键
⑥由非金属元素形成的化合物一定是共价化合物
 B .
B .  C .
C .  D .
D . 



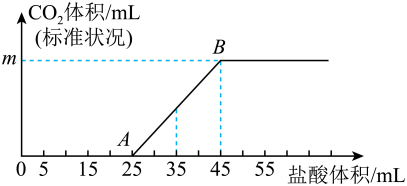
回答下列问题:
①0A段发生反应的离子方程式为。
②m=mL。
③原②溶液的物质的量浓度为。
【查阅资料】为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
。

装置A中所用浓盐酸浓度为11.6mol/L,现欲用其配制100mL,0.6mol/L的稀溶液。则需量取mL浓溶液,量取所用量筒的规格是(填“10mL”“25mL”或“50mL”)。若所配制的稀溶液浓度偏大,则可能的原因是(填字母)。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
第一步反应为: , 该反应氧化剂和还原剂的物质的量之比为;
第二步反应为:

已知:是酸性氧化物,且不与水反应。
回答下列问题:
氢氧化物 | |||
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
用氨水“调节pH”,pH的范围是。
IA | 0 | |||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||

分液漏斗内装入的试剂为(填物质名称),B中装入的试剂为(填物质名称),烧杯C中发生反应的离子方程式为。