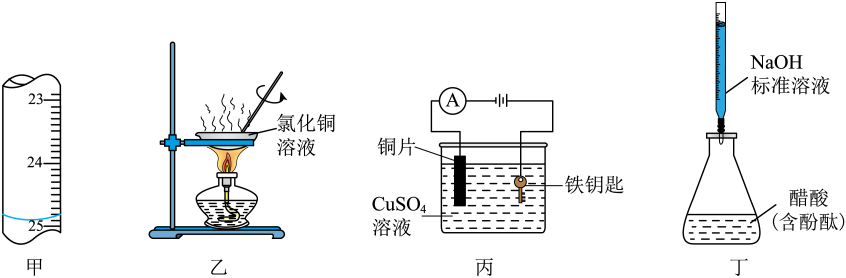


|
选项 |
实验操作和现象 |
实验目的或结论 |
|
A |
室温下,用 |
比较 |
|
B |
向 |
|
|
C |
取 |
该反应是可逆反应 |
|
D |
向等体积 |
|
下列说法正确的是( )

已知25℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11
①常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是(填序号)。
a.c(H+) b. c.c(H+)∙c(OH-)
d. e.
②请设计一个简单的实验验证醋酸与碳酸的酸性强弱
化学式 | H2C2O4 | |
电离平衡常数 |
①根据以上信息可知,Na2SO4溶液呈(填“酸”“碱”或“中”)性。
②少量Na2C2O4溶液与过量NaHSO4溶液反应的离子方程式为。
③室温下,pH=1的H2SO4溶液中,。

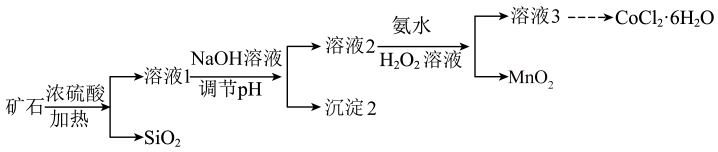
资料:生成
, 开始沉淀时
, 完全沉淀时
①已知:25℃时 , 当
时可认为
完全沉淀。若向溶液2中加入威溶液,常温下,当
时
完全沉淀。由此可知,通过调节
无法将
和
完全分离。
②溶液2中加入溶液的目的是。
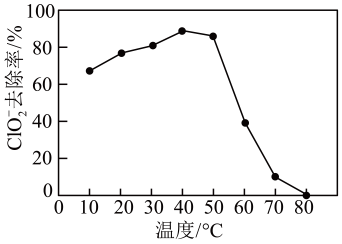

已知:2ClO2+2KI=2KClO2+I2 2Na2S2O3+I2=Na4S4O6+2NaI
计算该二氧化氯消毒液中的物质的量浓度。(写出计算过程)
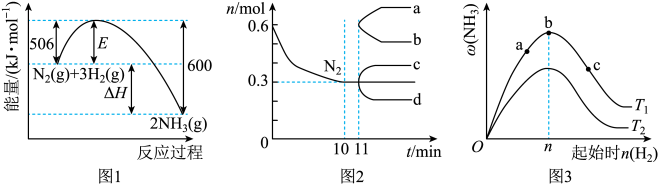
①已知2CO(g)+O2(g)=2CO2(g) ∆H=-566.0kJ/mol
2H2(g)+O2(g)=2H2O(l) ∆H=-571.6kJ/mol
CO与H2合成甲醇的能量变化如图1所示,则用CO2和H2制备甲醇和液态水的热化学方程式为。

②一定物质的量之比的和
在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图2所示。温度为
时,图中P点(填“处于”或“不处于”)平衡状态。
之后,甲醇产率下降的原因是。


①这种微胶囊吸收的原理是(写离子方程式)。
②在吸收过程中关于胶囊内溶液下列说法正确的是。
a.吸收前溶液中
b.吸收过程中,体系中的含碳微粒有
c.当时,溶液中
d.溶液中始终有
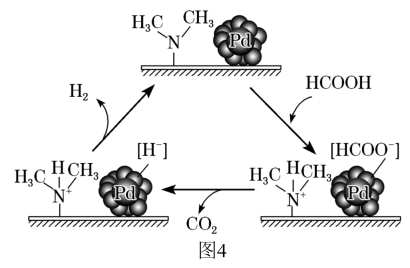
①在催化剂作用下,分解生成
和
可能的反应机理如图4所示。
催化释氢反应除生成
外,还生成(填化学式)。
②电催化加氢合成甲酸的工作原理如图5所示。

电极表面积对转化率和
选择性
的影响如图6所示。控制其他条件不变,电极表面积越大,生成
的量(填“越多”或“越少”或“无影响”);随者电极表面积的增大,
转化率增大且
选择性下降的原因是。
