
实验操作 | 现象 | 结论 | |
A | 将铜丝插入 FeCl3溶液中 | 铜丝溶解 | 铜的金属性大于铁 |
B | 向Zn-Fe-酸化的NaCl溶液形成的原电池的铁电极附近滴加K3[Fe(CN)6]溶液 | 铁表面有蓝色沉淀生成 | 锌不能作为保护铁的牺牲阳极 |
C | 25℃时测盐(MR)溶液的pH | pH=7 | 不能判断MOH和HR是否均为强电解质 |
D | 向苯酚浊液中滴加饱和Na2CO3溶液 | 浊液变澄清 | 苯酚的Ka大于碳酸的Ka1 |



下列说法正确的是
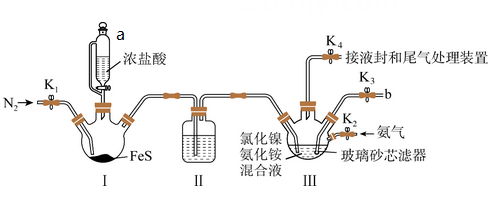
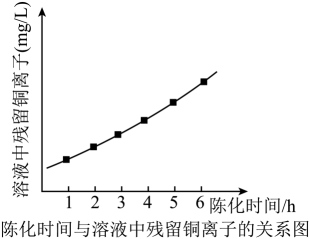
称取试样(杂质中不含Ni) mg置于锥形瓶中,用稀酸溶解后加入掩蔽剂掩蔽其他离子,加pH≈10的氨性缓冲溶液5mL紫脲酸铵指示剂少许。用0.0200mol/L EDTA (Na2H2Y)标准溶液滴定,发生反应: Ni2++H2Y2- NiY2-+ 2H+。滴定达终点时消耗EDTA标准溶液VmL。
①样品的纯度为。
②滴定过程中,若氨性缓冲溶液pH值过低,导致测得的产品纯度 (填“偏低”、 “偏高”或“不影响”)。

已知:①长期使用的催化剂,表面会覆盖积碳和有机物;
②Pt溶于王水生成NO和氯铂酸,该酸的阴离子具有正八面体结构,其中铂为正四价;
③该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
金属离子 | Al3+ | Mg2+ | Fe3+ |
开始沉淀的pH | 3.5 | 9.5 | 2.2 |
沉淀完全(c=1.0× 10-5mol/L)的pH | 4.7 | 11.1 | 3.2 |
回答下列问题:

由图可知,Pt 浸出的最佳条件为;


决定该过程的总反应速率的基元反应方程式为。
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b. CH3COOH* 比CH3COOH(g)能量高
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
反应i: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1 = -49.3 kJ·mol-1
反应ii: CO2(g) + H2(g CO(g)+ H2O(g) ΔH2
有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH2= kJ·mol-1

a. CO的分压不再发生变化
b.气体平均相对分子质量不再发生变化
c. 气体密度不再发生变化
d. 比值不再发生变化

①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是 (填“a”或“b”)。
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是。
③250℃时反应i: CO2(g)+3H2(g) CH3OH(g)+H2O(g)的 Kp=(MPa)-2(用最简分数表示)。
①含有两个苯环,且两个苯环通过一根单键直接相连;
②能发生银镜反应和水解反应,水解的产物之一能与FeCl3溶液发生显色反应;
③核磁共振氢谱有六组峰,且峰面积比为6: 2: 2: 1: 1。