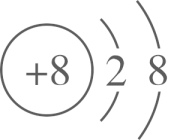 B . 基态铜原子价电子的轨道表示式:
B . 基态铜原子价电子的轨道表示式: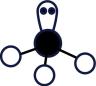 (正四面体形)
D .
(正四面体形)
D . 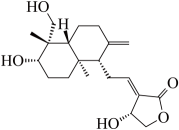
|
选项 |
实验方案 |
现象 |
结论 |
|
A |
室温下,向苯酚浊液中加入碳酸钠溶液 |
溶液变澄清 |
酸性: |
|
B |
向做过银镜反应的试管中加入足量氨水 |
银镜逐渐消失 |
银能与氨形成溶于水的配离子 |
|
C |
|
酸性 |
|
|
D |
向某溶液中加入稀硫酸 |
产生淡黄色沉淀,同时生成能使品红溶液褪色的无色气体 |
该溶液中含有 |

该化合物的化学式为,在晶体中与Cu距离最近且相等的Cu有个,若该晶体密度为
, 化合物式量为M,则该晶体中Cu原子与Br原子的最小核间距为pm(写出表达式,阿伏加德罗常数为
)。
![]()
已知
,
关系如下图。

①“焙烧”过程最大的是。
A. B.
C.
②“焙烧”温度应控制在。
①若该反应的速率方程表示为:和
[
和
分别为正、逆反应速率常数,在一定温度下为常数],该反应的平衡常数
(用
、
表示)。
②焙烧时在入口持续通入空气,并不断用真空抽气泵在装置尾端抽气的目的是。
Ⅰ.
Ⅱ.
Ⅲ.
上述反应在体积为1L的密闭容器中进行,达到平衡时各气体体积分数和反应温度的关系曲线如图甲所示。

①下列说法正确的是。
A.1530 K之前乙炔产率随温度升高而增大的原因:升温使反应Ⅱ、Ⅲ平衡正向移动
B.1530 K之后会有更多的甲烷与乙烯裂解生成碳导致乙炔产率增加不大
C.1530 K时测得气体的总物质的量为1.000 mol,则反应III的平衡常数为0.8652
D.相同条件下,改用更高效的催化剂,可使单位时间内的乙炔产率增大
②请在图乙中绘制平衡时乙烯的体积分数和反应温度的变化趋势,并标明1530 K时的气体体积分数。


已知:①一定浓度的金属离子生成相应的氢氧化物沉淀的pH如下表所示,
|
金属氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
|
|
7.6 |
9.6 |
|
|
2.2 |
3.4 |
|
|
4.1 |
5.4 |
②
(无色配离子)
请回答:

①从下列选项中选择合理的仪器和操作,补全如下步骤[“ ”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]
蒸馏水洗涤→润洗→( )→装液→( )→( )→用(量取一定体积的)→加指示剂,准备开始滴定。
仪器:a.烧杯;b.酸式滴定管;c.碱式滴定管;d.锥形瓶
操作:e.调整液面至“0”或“0”刻度以下,记录读数
f.橡皮管向上弯曲,挤压玻璃球,放液
g.打开活塞快速放液
h.控制活塞,将洗涤液从滴定管下部放出
i.将洗涤液从滴定管上口倒出
②滴定曲线如下图所示(曲线a未加磷酸,曲线b加磷酸)。滴定操作中向溶液中加入磷酸溶液的原因是:溶液酸化抑制水解、(写出两个理由)。

【实验一】铈量法测定含量。
取25.00 mL试液,用0.1000 mol/L的标准溶液滴定至终点。滴定反应为:
, 4次滴定消耗
溶液的体积如下,
|
实验次数 |
1 |
2 |
3 |
4 |
|
消耗 |
18.75 |
20.05 |
18.70 |
18.65 |
①则该产品中含量为%(保留四位有效数字)。
【实验二】高锰酸钾法测定含量。
取25.00 mL试液,加入适量硫酸,用0.0200 mol/L的高锰酸钾标准溶液滴定至终点。4次滴定测得的含量如下,
|
实验次数 |
1 |
2 |
3 |
4 |
|
|
19.61 |
20.17 |
21.26 |
19.46 |
②比较实验一、二测得的产品中含量,认为铈量法适合于乳酸亚铁中
含量的测定,原因是。
①分子中含有两个环;②谱和IR谱检测表明:分子中共有3种不同化学环境的氢原子,无−O−O−键。