物质 | 所含杂质 | 除去杂质的方法 | |
A | NaCl | Na2CO3 | 加入过量稀硫酸 |
B | CuO | Cu | 加入过量稀盐酸 |
C | CO | CO2 | 通入过量氢氧化钠溶液 |
D | NaOH | Ca(OH)2 | 加入过量碳酸钠溶液 |
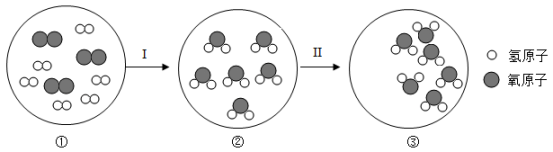
I、Cu2O中铜元素的化合价是,1mol Cu2O中约含有个Cu原子。
II、反应的化学方程式:X+Cu2O+CZn+2Cu+2CO2↑。则炉甘石主要成分X的化学式是,根据产物可知黄铜中含有的金属是


I、“捕捉室”中NaOH溶液常喷成雾状的优点是发生反应的化学方程式是。
II、“反应、分离”环节中,分离物质采用的方法是。
III、若要确认“捕捉”后的气体中CO2含量低,你的实验设计方案是。
操作 | 现象 | 结论 |
步骤一:取少量样品溶于水,先滴入酚酞试液,再滴入足量稀硝酸 | 样品中含有NaCl | |
步骤二:在上述反应所得的溶液中滴加溶液 | 产生白色沉淀 |
氯化钠和氢氧化钠的部分溶解度数据如下表。
温度(℃) | 0 | 20 | 60 | 80 |
NaCl | 35.7 | 36.0 | 37.1 | 38.4 |
NaOH | 42 | 109 | 174 | 314 |
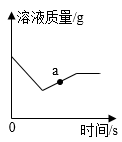
I、60℃时,NaCl的溶解度为g/100g水;20℃时,10g水中最多溶解NaOHg。
II、某同学进行如下实验:

i、溶液A中,NaOH(填“达到”或“未达到”)饱和状态。
ii、200g样品中NaOH的质量是。
iii、运用数据分析说明不能省略步骤III的原因。
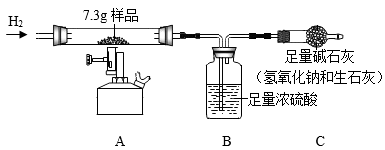
实验前先通一会儿氢气的原因是。
该生铁粉中铁元素的质量是g。