 点燃酒精灯
B .
点燃酒精灯
B . 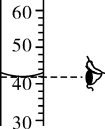 读取液体体积
C .
读取液体体积
C . 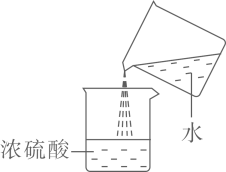 稀释浓硫酸
D .
稀释浓硫酸
D .  取用固体药品
取用固体药品
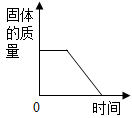 煅烧石灰石
B .
煅烧石灰石
B .  向NaOH溶液中加入稀盐酸
C .
向NaOH溶液中加入稀盐酸
C . 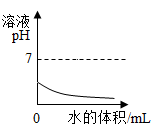 ③向盐酸中加水
D .
③向盐酸中加水
D . 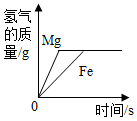 等质量的金属与足量盐酸反应
等质量的金属与足量盐酸反应
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 25 | 15 | 1 | 5 |
反应后的质量/g | 11 | X | 1 | 22 |
A.X 值为 3g B.乙全部发生了反应
C.甲与乙反应的质量比为 14:3 D.
实验目的 | 实验方案 | |
A | 鉴别纯棉布料和合成纤维布料 | 取样,灼烧闻气味 |
B | 除去氢氧化钠溶液中含有的少量碳酸钠 | 取样,加入足量氢氧化钙溶液,过滤 |
C | 除去氯化钙固体中混有的少量碳酸钙 | 取样,溶解,过滤 |
D | 鉴别硫酸钾和硝酸镁固体 |

A 硅属于金属元素
B 图中X=14
C 硅的相对原子质量为28.09 g
D 硅原子核外有3个电子层
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 49.6 |
NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
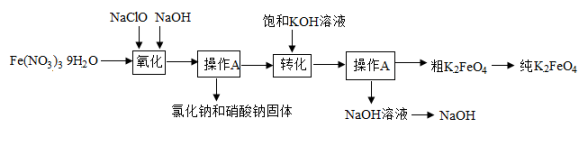


【查阅资料】①铜与空气中的气体作用可以生成Cu2(OH)2CO3(绿色固体)。
②黄铜中Zn含量越高硬度越大。
方法一:划画法
将黄铜片和纯铜片互相划观察到纯铜表面有刻痕,说明硬度更大;
该兴趣小组设计了如下图所示的两个实验方案。

组内同学经过讨论,认为方案一不合理。写出改进方法:。
方法一:利用如下图所示的实验测定黄铜中铜的质量分数。

将④的锥形瓶中所得的固体经一系列处理后进行称量,得质量为1.35g。计算黄铜中铜的质量分数为。

根据电子秤显示,可得黄铜样品粉末与稀硫酸反应生成氢气g。
回答下列问题: