 B . Cl-的结构示意图
B . Cl-的结构示意图 C . HClO的结构式为H-Cl-O
D . 质量数为37的氯原子
C . HClO的结构式为H-Cl-O
D . 质量数为37的氯原子①混合物:钢铁、水银、冰水混合物
②电解质:胆矾、氯化氢、硫酸钡
③酸性氧化物:CO、Al2O3、SO2
④同位素:2H2、1H、3H
⑤同素异形体:C60、金刚石、石墨
⑥干冰、液氯都是非电解质
| 选项 | 物质 | 杂质 | 除杂试剂或操作方法 |
| A | FeCl2溶液 | FeCl3 | 加入过量铜粉,再过滤 |
| B | NaHCO3溶液 | Na2CO3 | 通入过量的CO2气体 |
| C | NaNO3溶液 | Na2SO4 | 加入适量的BaCl2溶液,再过滤 |
| D | MgO固体 | Al2O3 | 加入过量的盐酸溶液,再过滤 |
①标准状况下,1LHCl和1LH2O的物质的量相同;
②常温常压下,1gH2和14gN2的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的摩尔质量成正比
⑦2molH2SO4分子的摩尔质量是196g/mol

写出“沉淀2”的化学式;
①定容 ②转移 ③量取 ④洗涤 ⑤稀释 ⑥摇匀
正确的操作顺序应是___________。
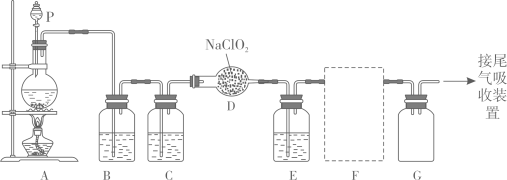
下图是实验室用于制备和收集一定量较纯净的的装置(某些夹持装置和垫持用品省略)。其中E中盛有
液体(用于除去
中的未反应的
)。

| 离子 | Fe3+ | Cu2+ | | Na+ | H+ |
| 浓度/(mol/L) | | | | |

①工业废水中加入铁粉生成固体C的离子方程为:。
②试剂B的化学式是。
③通过检验溶液D,来判断废水中是否除尽,实验方法是。
④上述废水经处理,可获得
的物质的量是
。
⑤在含有的溶液中加入
现象是;已知反应物恰好完全反应且反应转移
电子,生成的气体标况下的体积为L。