 B . 质子数为18、中子数为22的氩原子:
B . 质子数为18、中子数为22的氩原子:①单质分为金属和非金属两类;
②无机化合物主要包括:酸、碱、盐和氧化物;
③合金的熔点一定低于各成分金属
④按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体;
⑤在水溶液中或熔融状态下能导电的化合物都是电解质;
⑥按照树状分类法可将化学反应分为:氧化还原反应和离子反应;
⑦氧化还原反应的本质是化合价升降。
你认为他的笔记中正确的有几项
|
选项 |
实验操作和现象 |
离子方程式 |
|
A |
钠与水反应 |
2Na+2H2O=2Na++2OH-+H2↑ |
|
B |
刻蚀印刷电路板 |
Cu+Fe3+=Cu2++Fe2+ |
|
C |
H2O2溶液滴入酸性KMnO4溶液中,紫色褪去 |
2MnO |
|
D |
Ca(HCO3)2溶液中加入过量澄清石灰水 |
Ca2++2HCO |
|
选项 |
实验操作及事实 |
实验结论 |
|
A |
向某溶液中加入硝酸银溶液,产生白色沉淀 |
该溶液中一定含有Cl- |
|
B |
向某溶液中加入稀盐酸酸化的BaCl2溶液,有白色沉淀生成 |
该溶液中一定含有SO |
|
C |
向某溶液中加入稀盐酸,有无色无味气体生成,该气体能使澄清石灰水变浑浊 |
该溶液中可能含有CO |
|
D |
向某溶液中加入酸性KMnO4溶液,溶液紫色褪去 |
该溶液中一定含有Fe2+ |

|
|
|
|
|
|
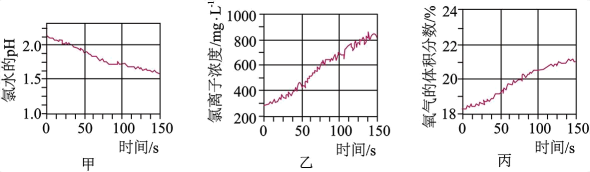
A.比较Na2CO3、NaHCO3的稳定性 |
B.排空气法收集CO2 |
C.钠的燃烧 |
D.溶液滴加 |

①沉淀减少时发生的离子方程式:。
②a点的数值为:mL。

H在潮湿空气中变成M的过程中的化学方程式:。
Q+B→N的离子方程式:。
①生成H2的物质的量之比为。
②消耗R的物质的量之比为。

实验开始时,先检查装置的气密性,再装好药品,打开止水夹,反应一段时间后关闭止水夹,I中的溶液沿导管流入II中,生成的白色沉淀可以保持较长时间,原因是:。
①如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。

②该实验中需要量取8mol•L-1的H2SO4溶液mL。

| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
I.打开弹簧夹,打开a的活塞,滴加浓盐酸。
II.当D和F中的溶液都变为黄色时,夹紧弹簧夹。
III.当D中溶液由黄色变为红棕色时,关闭a的活塞。
IV.打开活塞b,将少量F中溶液滴入E中,关闭活塞b,取下E振荡,静置后CCl4层变为紫红色
①过程IV的现象能证明溴的氧化性强于碘,反应的离子方程式是。
②过程III实验的目的是。
③氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,得电子能力逐渐减弱。