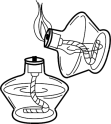
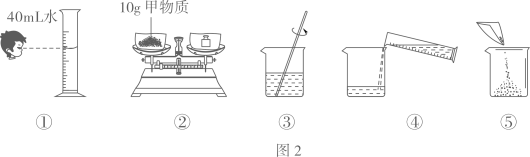
 B . 滴加液体
B . 滴加液体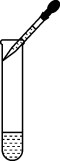 C . 移开蒸发皿
C . 移开蒸发皿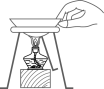 D . 读出液体体积
D . 读出液体体积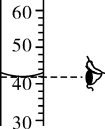
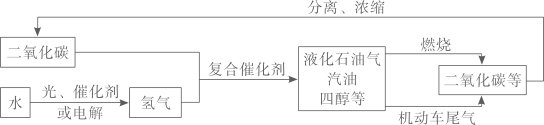

①图A中16表示的含义为;
②图B中x=_,硫原子在化学变化中容易(填“得到”或“失去”)电子,形成 (用离子符号表示) ;

①参加化学反应的两种物质的分子个数比为;
②该反应的化学力程式为;反应的基本类型是。
“大于”或“小于”)4%的食醋的pH,要使食醋的pH变大,可采用的方法是;
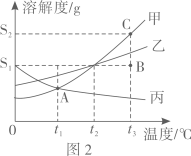
①图中A点的意义是;
②0℃时,甲、乙、丙三种固体物质的溶解度从大到小的顺序为;
③将t3℃时甲、乙、丙的饱和溶液降温至0℃,下列说法正确的是;
A.t3℃时,甲、乙、丙的饱和溶液的溶质质量分数由大到小的顺序是甲>乙>丙
B.降温至t2℃时,甲溶液析出晶体的质量大于乙溶液析出晶体的质量
C.降温至t1℃时,甲、丙溶液的溶质质量分数相等
D.在降温过程中,甲乙丙三种溶液均为饱和溶液
E.在降温过程中,只有丙溶液的溶质质量分数不变
④图2中B点是用50g水配制成的甲溶液,现需将甲溶液由B点状态移至C点状态,准确具体的操作是。
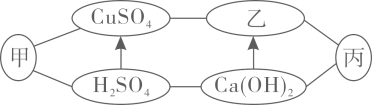
式;

①选用的发生和收集装置依次是;你选择上述发生装置的理由是
②向盛有12g大理石(杂质不参与反应)的反应容器中,加入100g稀盐酸,恰好完全反应后,反应容器内固体与溶液的总质量为107.6g,则该稀盐酸的溶质质量分数为。
作出猜想:反应产生的气体是①氢气;②二氧化碳;③氢气和二氧化碳。
他们作出猜想的依据是
[实验Ⅰ]取适量镁条、100mL Na2CO3溶液于反应装置A中,按如图1所示方案进行实验,B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。

作出猜想:可能是Na2CO3溶液中的某一种离子 (CO32-、Na+、OH-)促进了镁与水的反应。
[实验2]按图3所示方案进行实验。G、I中缓慢产生气泡,H中快速产生较多气泡,说明促进了镁与水反应的离子是CO3-而不是Na+、OH-。
实验2中G的作用是;试剂X是;
[实验3]取实验1反应生成的沉淀于试管中,加入试剂Y,根据实验现象说明白色沉淀中含有MgCO3 , 试剂Y是,该反 应的化学方程式为。
反思交流:有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。