


化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数: 98.9% |
A.防护手套 B.实验服 C.防毒面具 D.护目镜

A.升高温度 B.降低压强 C.减小的浓度 D.加入合适的催化剂
海盐→→
→
→
→滤液→饱和溶液……
→NaCl
根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
实验步骤 | 试剂 | 预期沉淀的离子 |
步骤1 | BaCl2溶液 | SO |
步骤2 | ||
步骤3 |

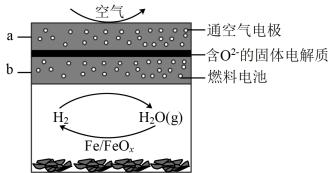
①若溶液为盐酸,Mg为极;
②若溶液为氢氧化钠溶液,负极的电极反应为。

①石墨1为(填“正极”或“负极”);
②正极的电极反应式为。
②若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为。