![]()
下列说法错误的是
|
A |
B |
C |
D |
|
|
|
|
|
|
制备 |
分离乙醇和乙酸 |
验证 |
测量 |
实验方案 | 现象 | 结论 | |
A | 往 | 短时间内无明显现象 |
|
B | 往 | 溶液先变成血红色后无明显变化 |
|
C | 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加 | 溶液呈浅绿色 | 食品脱氧剂样品中没有 |
D | 向沸水中逐滴加5~6滴饱和 | 溶液先变成红褐色再析出沉淀 |
|
选项 | 探究方案 | 探究目的 |
A | 向盛有 |
|
B | 向盛有 |
|
C | 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 |
|
D | 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 |
|
实验目的 | 实验方法或操作 | |
A | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
B | 探究浓度对化学反应速率的影响 | 量取同体积不同浓度的 |
C | 判断反应后 | 将 |
D | 检验淀粉是否发生了水解 | 向淀粉水解液中加入碘水 |

|
|
|
|
用量筒量取10.00mL盐酸 | 用瓷坩埚加热熔化NaOH固体 | 用分液漏斗分离乙酸异戊酯和水的混合物 | 配制一定温度的NaCl饱和溶液,用温度计测温并搅拌 |
A | B | C | D |
选项 | 实验操作及现象 | 结论 |
A | 将Na2S2O3溶液和稀H2SO4混合,得到沉淀,且生成的气体可使品红溶液褪色 | Na2S2O3既体现还原性又体现氧化性 |
B | 将Zn(OH)2固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 | Zn(OH)2既体现碱性又体现酸性 |
C | 将TiCl4液体和FeCl3固体分别暴露在潮湿空气中,只有前者会冒“白烟” | 水解性:TiCl4>FeCl3 |
D | 将红色固体CrO3加热,得到绿色固体Cr2O3 , 且生成的气体可以使带火星的木条复燃 | 热稳定性:CrO3<Cr2O3 |
已知:①雷尼暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼并探究其催化氢化性能的实验如下:
步骤1:雷尼的制备
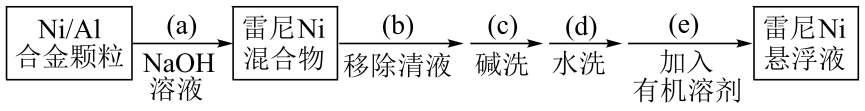
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存和监测反应过程。
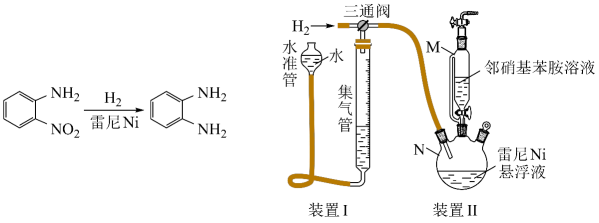
回答下列问题:


已知:①金属的化学性质和
相似,
的熔点为
;
②(乙醚)和
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
55.7 |
34.6 |
42.4 |
365.8 |
回答下列问题:


Ⅰ.制钠砂。向烧瓶中加入液体A和
金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 , 加入
噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 , 加入稍过量的环氧乙烷的四氢呋喃溶液,反应
。
Ⅳ.水解。恢复室温,加入水,搅拌
;加盐酸调
至4~6,继续反应
, 分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 , 静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品
。
回答下列问题:
a.乙醇 b.水 c.甲苯 d.液氨
 )的原因是。
)的原因是。

A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
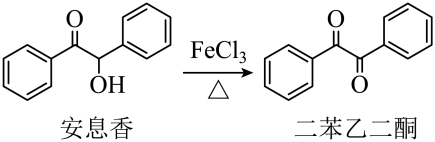
相关信息列表如下:
|
物质 |
性状 |
熔点/℃ |
沸点/℃ |
溶解性 |
|
安息香 |
白色固体 |
133 |
344 |
难溶于冷水 溶于热水、乙醇、乙酸 |
|
二苯乙二酮 |
淡黄色固体 |
95 |
347 |
不溶于水 溶于乙醇、苯、乙酸 |
|
冰乙酸 |
无色液体 |
17 |
118 |
与水、乙醇互溶 |
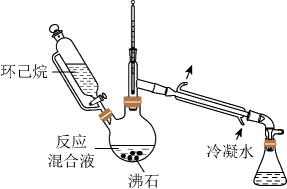
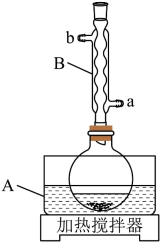
装置示意图如下图所示,实验步骤为:
①在圆底烧瓶中加入冰乙酸、
水及
, 边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入安息香,加热回流
。
③加入水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用的乙醇重结晶,干燥后得淡黄色结晶
。
回答下列问题:
a.热水 b.乙酸 c.冷水 d.乙醇
a. b.
c.
d.
具体步骤如下:
Ⅰ.称取 , 用
水溶解。
Ⅱ.分批加入后,将溶液温度降至
以下,加入
活性炭、
浓氨水,搅拌下逐滴加入
的双氧水。
Ⅲ.加热至反应
。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
仪器a的名称是。加快NH4Cl溶解的操作有。

用(称量样品
)→用烧杯()→用( )→用移液管()→用滴定管(盛装
标准溶液,滴定
)
仪器:a、烧杯;b、托盘天平;c、容量瓶;d、分析天平;e、试剂瓶
操作:f、配制一定体积的Zn2+溶液;g、酸溶样品;h、量取一定体积的溶液;i、装瓶贴标签
某研究小组取人血浆铜蓝蛋白(相对分子质量
),经预处理,将其中
元素全部转化为
并定容至
。取样测得荧光强度比值为10.2,则1个血浆铜蓝蛋白分子中含个铜原子。

(水层)+3HA(有机层)
(有机层)+
(水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是。
②反萃取的目的是将有机层转移到水层。使
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有(填两项)。
③与“反萃取”得到的水溶液比较,过滤溶液的滤液中,物质的量减小的离子有(填化学式)。


已知:①焙烧时过量的分解为
,
转变为
;
②金属活动性:;
③相关金属离子形成氢氧化物的范围如下:
开始沉淀 | 完全沉淀 | |
6.5 | 8.3 | |
1.6 | 2.8 | |
8.1 | 10.1 |
回答下列问题:
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度

制备流程图如下:

将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为。含有少量铜的废铁屑比纯铁屑反应快,原因为。
将与液体
混合并加热,制得无水
。已知
沸点为77℃,反应方程式为:
, 装置如下图所示(夹持和加热装置略)。

仪器A的名称为,其作用为。NaOH溶液的作用是。
a. b.
c.

Sn与Si同族,25℃时相关的溶度积见表。
化学式 | Sn(OH)4(或SnO2·2H2O) | Fe(OH)3 | Cu(OH)2 |
溶度积 | 1.0×10-56 | 4×10-38 | 2.5×10-20 |
①产品Na2SnO3中Sn的化合价是。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+ , 且无气体生成,则生成的硝酸盐是,废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2 , 焙烧时,与NaOH反应的化学方程式为。
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于mol•L-1。
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+ , 再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO被还原为I— , 终点时消耗KIO3溶液20.00mL。
①终点时的现象为,产生I2的离子反应方程式为。
②产品中Sn的质量分数为%。

①三颈烧瓶中加入香菇样品和
水;锥形瓶中加入
水、
淀粉溶液,并预加
的碘标准溶液,搅拌。
②以流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液。
③做空白实验,消耗了碘标准溶液。
④用适量替代香菇样品,重复上述步骤,测得
的平均回收率为95%。
已知: ,
回答下列问题:
在通风橱中用下图装置制备(加热及夹持装置省略),反应方程式:

装置A中盛放甲酸的仪器的名称是。
将通入新制银氨溶液中,有黑色沉淀生成。
将一定量与空气混合,得到
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
, 按一定流速通入气体样品。(已知:
是白色固体,易吸水潮解:
)

通入(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
。
①能证明被空气氧化的现象是;
②被催化氧化的百分率为;
③若未通入氮气,②的结果将(填“偏大”“偏小”或“无影响”)。

①存贮时,Na应保存在中。
②冷凝水的进口是(填“a”或“b”)。
③用Na干燥甲苯的原理是(用化学方程式表示)。
④回流过程中,除水时打开的活塞是;体系变蓝后,改变开关状态收集甲苯。

①在Ar气保护下,反应物在A装置中混匀后转入B装置,于280℃加热12小时,反应物完全反应。其化学反应方程式为。用Ar气赶走空气的目的是。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是和。
③所得纳米球状红磷的平均半径R与B装置中气体产物的压强p的关系如图3所示。欲控制合成R=125nm的红磷,气体产物的压强为kPa,需NaN3的物质的量为mol(保留3位小数)。已知:p=a×n,其中a=2.5×105kPa•mol-1 , n为气体产物的物质的量。


回答下列问题: