 B .
B .  C .
C .  D .
D . 

B . 量取水的体积
B . 量取水的体积 
C . 加热食盐水
C . 加热食盐水 
D . 稀释浓硫酸
D . 稀释浓硫酸 



则下列说法正确的是( )

 C . 生铁与钢的区分:
C . 生铁与钢的区分: D . 20℃时固体溶解度的相对大小:
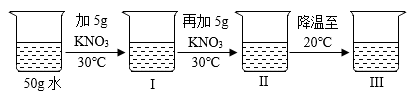
D . 20℃时固体溶解度的相对大小:
|
|
实验目的 |
实验方案 |
|
A |
测定某废水的酸碱度 |
取样,将湿润的pH试纸浸入样品中 |
|
B |
验证某可燃性气体中含有H2 |
点燃气体,在火焰上方罩干冷烧杯 观察烧杯内壁是否出现液滴 |
|
C |
鉴别氮肥(NH4Cl)和钾肥(KCl) |
取样,加稀盐酸,闻气味 |
|
D |
鉴别稀盐酸和稀硫酸 |
取样,滴加BaCl2溶液,观察是否变浑浊 |
①居民燃煤取暖 ②退耕还林 ③燃放烟花爆竹 ④焚烧秸秆
锂曾经被称为“白色黄金”,锂是一种活泼的金属,在空气中极易与氮气和氧气反应生成氮化锂(Li3N)和氧化悝(Li2O),锂还能与水反应,生成氢氧化锂和氢气。锂还是最轻的金属,会漂浮在油的表面,常封存在固体石蜡中。锂与生活息息相关,锂电池中就含有锂元素,电池组件的设计以轻巧为主,假如电池受损,就会发生短路,一星点火花也可点燃高活性锂,电池被加热到热失控的程度,内容物的热量对电池施压,便有可能导致电池爆炸。
尽管锂电池如今已经无处不在,且获得诺贝尔奖加持。但这也意味着锂离子的需求量来到空前高峰,供不应求,被欧盟列入“关键原料清单”,因此我们需要更好、更实惠的电池,钠离子电池是一种丰富且价格合理的锂替代品。钠离子电池作为新一代价格便宜,性能优良且安全性更高的电池,有潜力替代锂离子电池。相比于锂元素,钠离子电池的优势在于资源丰富,钠资源约占地壳元素储量的2.64%,获得钠元素的方法也十分简单,因此钠离子电池在成本上将更加具有优势。而重要的是,钠离子电池的运行可以采用铝作为阳极材料,相比于铜作阳极材料,铝的使用避免了过度放电带来的危险性和问题。

查阅资料:SiO2不溶于水,常温下也不与盐酸反应。回答下列问题:

A.SO2 B.H2 C.CO D.HCl
项目一盐酸的工业制法——燃烧法
【查阅资料】
第一步:将饱和食盐水进行电解,生成氢氧化钠、氢气和氯气。
第二步:在反应器中将氢气和氯气点燃制得氯化氢气体。
第三步:气体冷却后用冷水吸收得到盐酸。
|
实验操作 |
实验现象 |
实验结论 |
|
取少量氧化铁于试管中,加入2mL稀盐酸 |
|
稀盐酸能和Fe2O3反应 |
实验操作 | 实验现象 |
①取少量Fe2O3于试管中,加入2mL蒸馏水 | 无明显现象 |
②取少量Fe2O3于试管中,加入2mL | 无明显现象 |
根据上述实验得出结论:。
| 序号 | 0 | 溶质质量分数 | 温度/℃ | 时间/min |
| ① | 盐酸 | 5% | 25 | 12 |
| ② | 磷酸 | 3% | 25 | 15 |
| ③ | 柠檬酸 | 3% | 25 | 14 |
根据实验②、③,对比分析可得出的结论是。
①、②对比(填“能”或“不能”)说明酸的溶质质量分数会影响铁锈与酸的反应速率。
|
操作 |
第一次 |
第二次 |
第三次 |
第四次 |
|
剩余固体质量 |
21.6g |
19.2g |
15.2g |
15.2g |