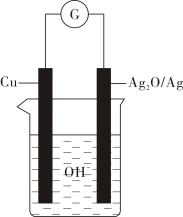
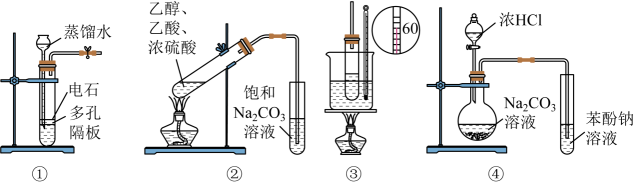
选项 | 实验操作 | 实验目的或结论 |
A | 将氯乙烷与氢氧化钠溶液共热一段时间,再 向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
B | 将缠绕铜丝灼烧后反复插入盛乙醇的试管,然后滴入酸性高锰酸钾溶液 | 乙醇催化氧化生成乙醛 |
C | 向苯中滴加溴水,再加入铁粉 | 制备溴苯 |
D | 向汽油和植物油中分别加入一定量的NaOH溶液加热振荡,观察油层是否消失或变浅 | 鉴别植物油和矿物油 |
 分子中共平面的原了最多为15个
C . 异戊烷的一氯代物有3种
D . 室温下,在水中的溶解度:乙二醇
分子中共平面的原了最多为15个
C . 异戊烷的一氯代物有3种
D . 室温下,在水中的溶解度:乙二醇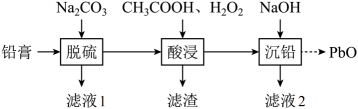
已知:室温下,、
、
。
、
完全沉淀时的pH分别是3.2和4.6;
开始沉淀时的pH是7.2。
下列说法正确的是( )
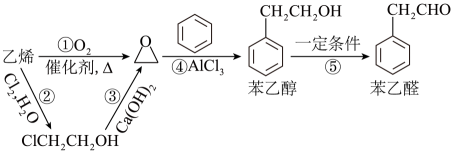
①烃的分子式为;
②若烃能使溴水褪色,在催化剂作用下与
加成,其加成产物分子中含有4个甲基,烃A可能的结构简式有种。
①甲苯与浓硝酸、浓硫酸混合制TNT
②1,3-丁二烯制备1,4-溴-2-丁烯
 的一氯代物具有不同沸点的产物有种。
的一氯代物具有不同沸点的产物有种。② 系统命名的名称为。
系统命名的名称为。
③写出2-丁烯在一定条件下加聚产物的结构简式。

①图中点的
正
点的
(正)(填“>”“<”或“=”);用
表示从
内该反应的平均速率
。
②在该温度下,计算达到平衡状态时的转化率是
③对于该化学反应原理,说法不正确的是
A.反应过程中,容器内压强不再变化,说明反应达到平衡
B.反应过程中,气体密度维持不变,说明反应达到平衡
C.增大压强能提高的转化率,同时也能提高
的平衡产率
D.加入对反应催化效果更佳的催化剂,加快反应速率,但不能提高的平衡转化率
E.升高温度,平衡正向移动,正反应速率增大,逆反应速率减小
①的反应历程分以下两步:
第一步;
第二步(用含
、
的式子表示)
。
②催化还原
是重要的烟气脱硝技术,研究发现在以
为主的催化剂上可能发生的反应过程如图。请写出脱硝过程的总反应的化学方程式:。


①若该反应的正、逆反应速率分别可表示为 ,
, k正、k逆分别为正、逆反应速率常数,A、B两点对应的时刻,该反应的正反应速率之比
。
②若平衡时总压强为 , 用平衡分压代替其平衡浓度表示的化学平衡常数
[已知:气体分压
气体总压
该气体的体积分数]。
可能用到的有关数据如下:
|
密度 |
沸点 |
溶解性 |
|
|
环己醇 |
0.9618 |
161 |
微溶于水 |
|
环己烯 |
0.8102 |
83 |
难溶于水 |
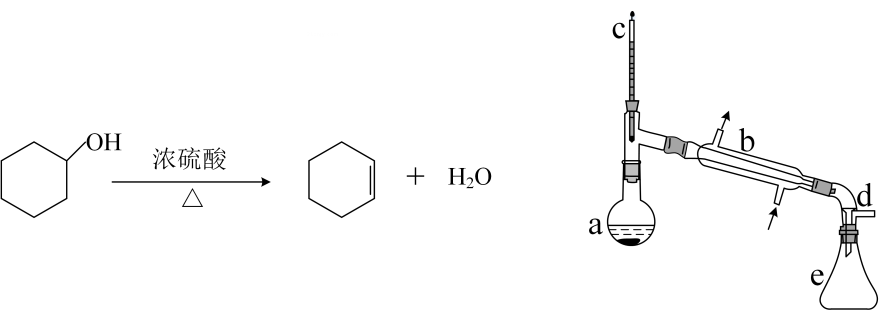
合成反应:
在中加入
环己醇和2小片碎瓷片,冷却搅动下慢慢加入
浓硫酸。b中通入冷却水后,开始缓慢加热
, 控制馏出物的温度不超过
。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯
。
回答下列问题:
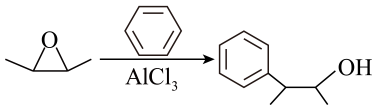
 )的合成路线(用流程图表示,其他试剂任选)。
)的合成路线(用流程图表示,其他试剂任选)。