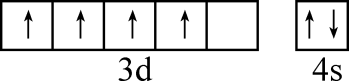
 B . 氯化氢的电子式:
B . 氯化氢的电子式: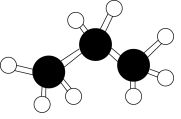 D . 乙烯分子中的π键:
D . 乙烯分子中的π键: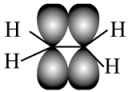
|
选项 |
实验目的 |
实验设计 |
|
A |
证明非金属性Br>I |
比较等浓度HI和HBr溶液的酸性 |
|
B |
检验溶液中的 |
向溶液中加入 |
|
C |
除去 |
将混合气体通入饱和 |
|
D |
验证干燥 |
将 |
选项 | 现象或事实 | 解释 |
A | 对羟基苯甲醛沸点高于邻羟基苯甲醛 | 对羟基苯甲醛分子间形成氢键,而邻羟基苯甲醛形成分子内氢键。分子间氢键对沸点影响更大 |
B | | |
C | 三氟乙酸的酸性比乙酸的酸性强 | F酸性强于H,三氟乙酸中具有多种酸性基团 |
D | 乳酸( | 乳酸中存在手性碳原子 |
A.二氧化锰 B.固体 C.硝酸钠
①的核外电子排布式是,过渡金属离子与水分子形成配合物时,若d轨道全空或全满时,化合物无颜色,否则有颜色。据此判断,
(填“有”或“无”)颜色。
②可形成多种配合物,如
, 若其中两个
被
替换,得到的配合物只有两种结构,则
的空间构型是,
中N原子的杂化方式是,空间构型是。

①Cu原子的配位数是。
②原子坐标参数,表示晶胞内部各原子的相对位置,其中原子坐标参数A为;B为
;C为
。则D原子的坐标参数为。
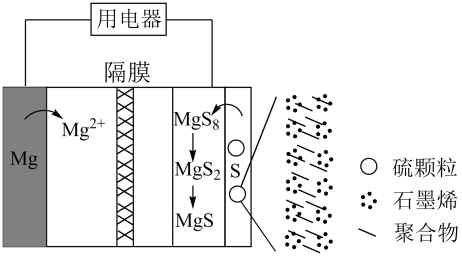
已知:①常温下,。
②相关金属离子[ mol⋅L
]形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| 7.6 | 9.4 |
| 3.0 | 5.0 |
| 5.4 | 8.0 |
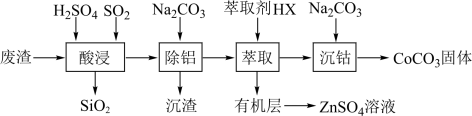
A.稀硫酸 B.NaOH溶液 C.酒精 D.四氯化碳
反应Ⅱ.
kJ⋅mol
则反应Ⅲ.的
等于,该反应能自发的条件是(填“低温”或“高温”)。
时间/min | 0 | 2 | 4 | 6 | 8 |
| 2.0 | 1.5 | 1.2 | 1.0 | 1.0 |
①2~4 min内,用表示的化学反应速率
。
②6 min时,的消耗速率
的生成速率(填“大于”“小于”或“等于”)。
③写出既能加快反应Ⅲ的反应速率,又能提高反应Ⅲ中转化率的措施:(写出一条即可)。


a.B中所有原子均共平面 b.C中σ键和π键数目比为6∶1
c.D中所有碳原子均采用杂化 d.H中存在手性碳原子
①相对分子质量比B大14;②属于B的同系物。