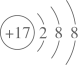 C . 甲烷分子的空间填充模型:
C . 甲烷分子的空间填充模型:
选项 | 实验操作 | 实验目的 |
A | 将海带灰溶于水,过滤,向滤液中滴加淀粉溶液 | 检测海带中含有碘元素 |
B | 将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 | 证明SO2的漂白性 |
C | 向硅酸钠溶液中通入CO2气体,有白色沉淀产生 | 验证H2CO3的酸性强于H2SiO3 |
D | 向市售乙醇中加入一小粒钠,有气泡产生 | 检测市售乙醇中存在水 |
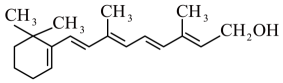 。下列有关维生素A的叙述正确的是( )
。下列有关维生素A的叙述正确的是( )

实验序号 | 铁的质量(g) | 铁的形态 | V(H2SO4)(mL) | c(H2SO4)( | 反应前溶液的温度(℃) | 金属完全消失的时间(s) |
1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
实验1、2表明对反应速率有影响。
Ⅰ.在甲试管(如图)中先加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片;
Ⅱ.按图连接好装置(装置气密性良好),小火均匀地加热3~5 min;
Ⅲ.待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。

①加入碎瓷片的目的是。
②与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是。
实验编号 | 甲试管中试剂 | 乙试管中试剂 | 有机层的厚度/cm |
A | 2 mL乙醇、1 mL乙酸、3 mL | 饱和Na2CO3溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸、3 mL H2O | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、3 mL | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是mL和
。
②若加入的乙酸为120 g,乙醇为138 g,发生酯化反应得到132 g乙酸乙酯,试计算该反应的产品的产率为(产率)。
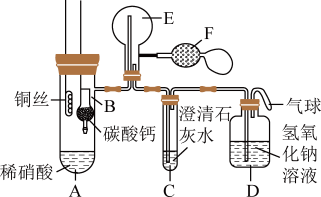
实验步骤与现象如下:
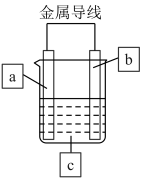
Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触,产生气体;
Ⅱ.当C装置中产生白色沉淀时,立刻将B装置上提;
Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热,A装置中产生无色气体,E装置中开始时出现浅红棕色气体;
Ⅳ.用F装置向E装置中鼓入空气,E装置中气体颜色逐渐加深;一段时间后,装置C中白色沉淀溶解。
回答下列问题:
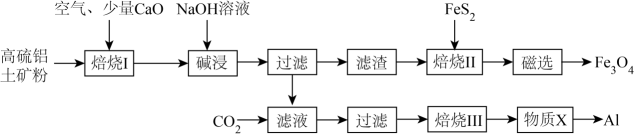
已知:①FeS2在“焙烧Ⅰ”过程中,发生反应的化学方程式为;②“焙烧Ⅱ”在隔绝空气的条件下发生反应的化学方程式为
。