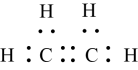
 C .
C . 

 B . 硒元素最高正价与最低负价代数和为4
C . 依据元素周期律推测硒化氢的熔沸点及热稳定性均高于硫化氢
D . 硒元素位于金属与非金属分界线附近推测硒可用作半导体材料
B . 硒元素最高正价与最低负价代数和为4
C . 依据元素周期律推测硒化氢的熔沸点及热稳定性均高于硫化氢
D . 硒元素位于金属与非金属分界线附近推测硒可用作半导体材料
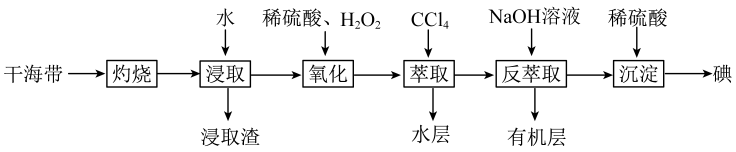
|
选项 |
实验目的 |
实验操作 |
|
A |
除去乙烷中的乙烯 |
将气体通过盛有酸性 |
|
B |
证明能与 |
向盛有 |
|
C |
比较得电子能力: |
将足量硝酸滴入到 |
|
D |
探究乙醇在铜丝作用下发生催化氧化 |
取一根洁净、红亮的铜丝,前端绕成螺旋状,置于酒精灯外焰灼烧,然后慢慢移向内焰,迅速取出 |
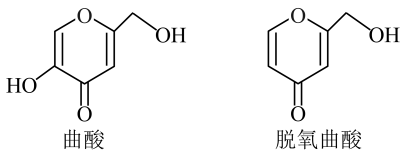

①温度由升至
过程中,发生反应的化学方程式为。
②点所得固体的化学式为。
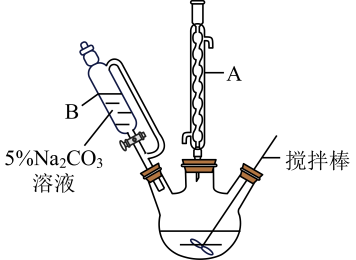
实验步骤:
Ⅰ.将丁酸和
甲醇加入到三颈烧瓶中,再加入
浓硫酸,混合均匀。
Ⅱ.加热三颈烧瓶,控制温度为 , 搅拌3—8h,充分反应。
Ⅲ.冷却,向混合液中加入溶液洗至中性。
Ⅳ.分液,取上层油状液体,加入无水固体,过滤后蒸馏,收集102~105℃馏分。
已知:几种物质的性质见下表
|
|
沸点 |
溶解性 |
性质 |
|
丁酸 |
163.5 |
与水互溶,易溶于有机溶剂 |
低毒 |
|
甲醇 |
64.7 |
与水互溶,易溶于有机溶剂 |
易挥发,有毒 |
|
丁酸甲酯 |
103 |
微溶于水,易溶于有机溶剂 |
易挥发 |
回答下列问题:

①含有苯环;
②能使新制转化为砖红色沉淀
③能发生水解反应,且水解产物中苯环只与碳原子成健
 反应可以得到
反应可以得到
图1
①已知—甲基咪唑分子具有类似苯环的结构,则该分子中存在的大
健应表示为,连甲基的
原子的价层孤电子对占据轨道。
②每个含有个
键;除
键外,
中还存在的化学键有(填标号)。
A.极性键 B.非极性键 C.离子键 D.范德华力 E.配位键

①该分子中属于第二周期的非金属元素第三电离能由大到小的顺序为(用元素符号表示)。
②是微电子工业中一种优良的等离子蚀刻气体,其分子空间构型与
相似,键角
(填“大于”“等于”或“小于”),原因是。