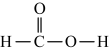 B . 乙醇的球棍模型:
B . 乙醇的球棍模型: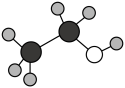 C . 甲酸乙酯的结构简式:CH3COOCH3
D . H2O的电子式:
C . 甲酸乙酯的结构简式:CH3COOCH3
D . H2O的电子式: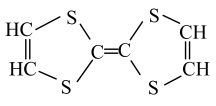
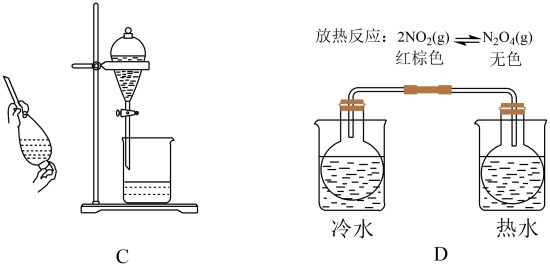
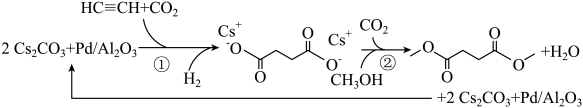
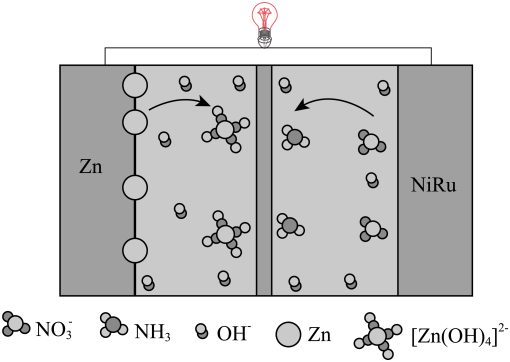
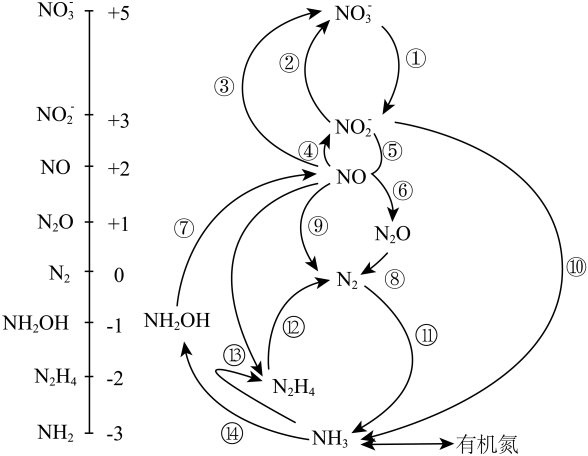


①可用(填试剂名称)检验物质b中的醛基。
②0.2mol c和足量的钠反应可生成LH2(标准状况)。

①利用四氟乙烯合成聚四氟乙烯的化学方程式为。
②b极的电极反应式为。
③若反应生成18gH2O,理论上外电路转移的电子的数目是。
实验 序号 | KMnO4溶液 | H2C2O4溶液 | H2SO4溶液 | 褪色时间 | ||
c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | t/s | |
1 | 0.005 | 4.0 | 0.2 | 2.0 | 0.120 | 307 |
2 | 0.020 | 4.0 | 0.2 | 2.0 | 0.120 | 545 |
3 | 0.010 | 4.0 | 0.5 | 2.0 | 0.120 | 201 |
4 | 0.010 | 4.0 | 0.7 | 2.0 | 0.120 | 163 |
5 | 0.010 | 4.0 | 0.9 | 2.0 | 0.120 | 360 |
6 | 0.010 | 4.0 | 1.0 | 2.0 | c1 | 512 |
①c1=。
②某同学从实验1和2的褪色时间分析出实验2的反应速率小于实验1,请分析该结论是否正确,并说明原因:。
③结合实验数据,下列说法错误的是。(填标号)
A.其他条件不变时,c(H2C2O4)浓度越高,反应速率越快
B.其他条件不变时,当c(H2C2O4)为0.8mol·L-1 , 褪色时间一定介于163s至360s之间
C.实验5中v(H2C2O4)=0.15mol·L-1·min-1
D.其他条件不变时,当c(H2C2O4)>0.9mol·L-1 , 溶液浓度增大,不利于CO2扩散,可能导致褪色时间延长
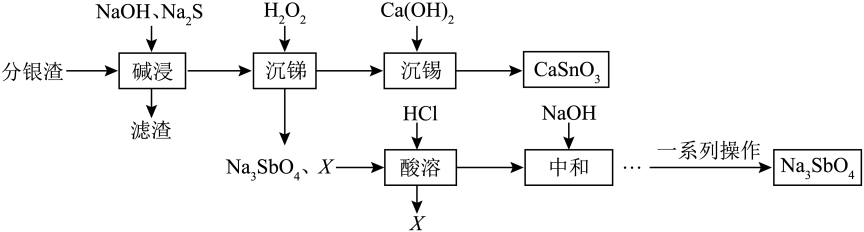
查阅资料:①Sn和C属于同主族元素,Sb和N属于同主族元素。
②“碱浸”中Sb元素发生反应的离子方程式为:、
