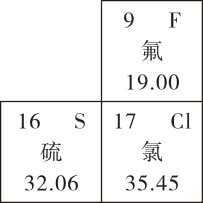
 B . 硫原子的相对原子质量为 32.06g
C . 氟元素和氯元素处于同一周期
D . 硫元素和氯元素具有相似的化学性质
B . 硫原子的相对原子质量为 32.06g
C . 氟元素和氯元素处于同一周期
D . 硫元素和氯元素具有相似的化学性质
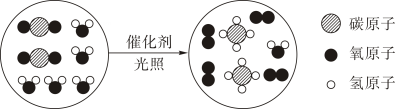
|
选项 |
实验目的 |
实验试剂或操作 |
|
A |
除去碳粉中混有铁粉 |
加入适量硫酸铜溶液,充分反应后过滤 |
|
B |
除去氯化钠中混有的碳酸钠 |
加入过量稀硫酸,充分反应后蒸发结晶 |
|
C |
除去氢气中混有的一氧化碳 |
通入适量氧气,再将气体点燃 |
|
D |
除去硝酸铜溶液中混有的硝酸银 |
加入足量铜粉,充分反应后过滤 |
|
|
实验操作 |
现象 |
结论 |
|
A |
向某待测液中加氯化钙溶液 |
有白色沉淀生成 |
该溶液为AgNO3溶液 |
|
B |
将CO通入灼热的氧化铁粉末中 |
粉末由红色变为黑色 |
CO有还原性 |
|
C |
将2根铜丝分别放入硫酸铝溶液和硝酸银溶液中,观察现象 |
硫酸铝溶液没有明显现象,硝酸银溶液逐渐变蓝,其中铜丝表面有银色物质析出 |
金属活动性顺序:Al>Cu>Ag |
|
D |
将铜片和黄铜片相互刻画 |
铜片上留下划痕,黄铜片无明显现象 |
合金硬度比组成它的纯金属硬度大 |

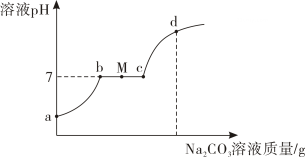
① ; ②。


a、液面低于隔板,与固体脱离接触 b、关闭弹簧夹 M c、U 型管右边液面下降
下列反应不适用于装置 C 的是(填字母)。
A、块状大理石和稀盐酸反应制取二氧化碳气体
B、锌片和稀硫酸反应制取氢气
C、高锰酸钾粉末和浓盐酸反应制取氯气(Cl2)
② ,
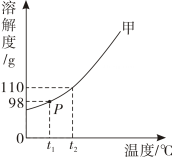
③20℃时,NaHCO3、NH4HCO3的溶解度见下表。
|
物质 |
NaHCO3 |
NH4HCO3 |
|
溶解度/g |
9.6 |
21 |
|
实验序号 |
反应温度/℃ |
反应时间/min |
NaHCO3产率/% |
|
a |
T1 |
60 |
86.8 |
|
b |
T1 |
120 |
92.1 |
|
c |
T2 |
60 |
X |
|
d |
T2 |
120 |
92.5 |
|
e |
T3 |
60 |
85.3 |
|
f |
T3 |
120 |
85.6 |
①实验 a 和 b 的结论是;
②表格中 X 的数值可能是(选填字母编号);
A.85.8
B.86.8
C.89.4
D.92.6
③在相同反应时间,T3℃时碳酸氢钠的产率比 T1℃和 T2℃时都低,据此推测 T3≥。
①亚硒酸钡(BaSeO3)与稀硝酸反应可生成硒酸钡(BaSeO4),硒酸钡(BaSeO4)中硒元素的化合价为:,写出硒酸的化学式:;
②依据各物质之间的反应规律,设计两种制备亚硒酸钡(BaSeO3)的方案(要求依据两种不同的反应规律)。完成下表:
|
方案 |
操作 |
预期反应的化学方程式 |
|
① |
往盛有 Na2SeO3溶液的烧杯中滴加足量溶液,充分反应后,(填操作名称)。 |
|
|
② |
往盛有的烧杯中滴加足量溶液,充分反应后,后续操作同上。 |
|