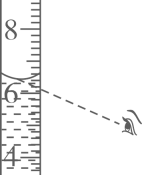
 B .
B .  C .
C .  D .
D . 



 B . 溶解粗盐
B . 溶解粗盐 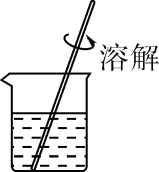 C . 过滤悬浊液
C . 过滤悬浊液  D . 蒸发滤液
D . 蒸发滤液 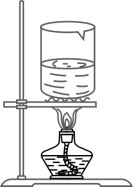
| 温度/℃ | 20 | 40 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 117 | 121 | 126 | 139 |
| KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |


①文物上的金箔不易变色,说明黄金的化学性质 (选填“稳定”或“活泼”)。
②虎丘云岩寺塔的塔身用砖块砌成,采用生石灰拌泥沙来粘合。生石灰在形成CaCO3的过程中(见下图所示),能把泥沙和砖块牢牢粘合在一起。这个过程中发生两个反应的化学方程式为 。

①新能源汽车的电池充电时有能量转换,电能转化为 。
②高铁车轨采用的是无缝钢轨,铝热焊是一种焊接方式。将粉末状的Al和Fe2O3放在坩埚内稍加热就能持续反应,将产生的铁水注入铸型进行焊接,生成的熔渣主要为Al2O3。该反应的化学方程式为 ,此反应 (填“放热”或“吸热”)。
①苏州人居环境有口皆碑。下列做法能更好地治理和防止水污染的是 (填字母)。
A.研究化学反应条件和工艺,实现化工产品的无污染生产
B.研制无污染的化肥和农药,研制无磷洗涤剂
C.研究高效率、低消耗的污水处理技术,对污水进行综合治理
②为了防止电镀工业污泥中的铜元素污染环境,利用加压氢还原法可制备化工原料氧化亚铜(Cu2O),主要流程如图所示。
补全制备氧化亚铜的化学方程式:2CuSO4+H2+ Cu2O
+2H2SO4。“废液”经加入熟石灰处理后方可排放,主要反应的化学方程式为 。

A.
B.2NaOH+H2SO4=Na2SO4+2H2O
C.
D.2Na+H2SO4=Na2SO4+H2↑
②在反应2H2S+SO2=2H2O+3S↓中,氧化产物和还原产物的质量比为 。
②如果少量浓硫酸沾到皮肤或衣物上,必须迅速用 ,再涂上碳酸氢钠溶液(3%~5%)。碳酸氢钠与硫酸反应的化学方程式为 。
②分别用pH和溶液电导率(表示溶液传导电流的能力)传感器对Ba(OH)2溶液与稀硫酸反应进行探究,测定结果见图1和图2。下列说法中正确的是 (填字母)。

A.由如图1可知,实验是向稀Ba(OH)2溶液中滴入稀硫酸
B.图2中0s~6s,说明溶液中有带电离子
C.如图2中6s~30s,电导率下降是因为带电离子的数目减少
D.M点和N点均表示Ba(OH)2和H2SO4恰好完全反应
| 乙醇:92汽油 | 10:0 | 9:1 | 8:2 | ... | 2:8 | 1:9 | 0:10 |
| 热值(J/g) | 29408.02 | 21498.63 | 28184.60 | ... | 31254.94 | 33932.09 | 29684.78 |
①每46g乙醇完全燃烧,需要消耗O2的质量为 ,理论上可放出热量为 (结果精确到1kJ)。
②若需燃烧放热最多,根据上表中数据,乙醇汽油中乙醇的最佳体积分数为 。



图2:600℃时,Mo:Fe对Fe-Mo/C催化裂解乙醇产氢率的影响。图3,反应温度对于Mo-Fe(5%,Mo:Fe=1:9)/C催化剂裂解乙醇产氢率的影响。根据图2和图3,下列说法不正确的是(填字母)。
| A. Fe/C催化剂中加入Mo一定能提高裂解乙醇产氢率 |
| B.反应温度越高,Fe-Mo/C催化裂解乙醇的效果越好 |
| C.反应温度在600℃且Mo: Fe=1:9时,氢气产率最佳 |
| D. Mo-Fe/C催化剂能持续催化乙醇裂解,并保持产氢率不变 |
A.当导管口出现均匀且连续气泡时,将其伸入集气瓶口
B.当集气瓶中水被排尽,瓶口有大气泡向外冒出时取出导管
C.将集气瓶口朝下提出水面,再盖上玻璃片,倒放在桌面上
D.收集结束后导管仍要放在水中,并立即熄灭酒精灯,以防失火
②用装置G收集O2 , 气体应从 (填“a”或“b”)端通入,在另一端用 检验。
用大理石和稀盐酸制取CO2的化学方程式为 。
②用图2所示装置除去HCl气体,并获得干燥的CO2。

收集装置应选用图1中 (填字母)。装置中所盛试剂应选用下面表格中的 组(填字母)。(CO2不与饱和NaHCO3溶液反应)
| A组 | B组 | C组 | D组 | |
| X | 浓硫酸 | 浓硫酸 | 饱和NaHCO3溶液 | 饱和NaOH溶液 |
| Y | 饱和NaOH溶液 | 饱和NaHCO3溶液 | 浓硫酸 | 浓硫酸 |


用图3所示装置进行H2还原CuO的实验,完全反应的化学方程式为H2+CuOCu+H2O,但实验后试管中得到红色固体也可能是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中能溶于氨水得到蓝色溶液。
①实验室使用锌粒和稀硫酸反应制取氢气,该反应的化学方程式为 。
②为证明固体产物中有 Cu2O,需进行的操作及现象为 。
①0.6000g的CuO和H2完全反应可得金属铜的质量为多少克 ?(写出计算过程)
②由图4,在H2还原CuO反应过程中,固体中Cu2O质量的变化趋势是 。
③为确保H2还原CuO所得固体产物不含Cu2O,应采取的措施是 。

“沉淀”时的反应为:2FeCl3+FeCl2+8NH3·H2O=Fe3O4 +8NH4Cl+4H2O
①“沉淀”时需要控制反应温度为不宜过高,其原因是 。
②“溶解”时,实际投放的远大于理论值,其原因是 。
① 高温下,铁酸锌(ZnFe2O4)可被CO选择性还原为ZnO和Fe3O4 , CO转化为CO2。该反应的化学方程式为 。
② 在恒压条件下,反应温度、反应体系中CO的体积分数 , 对还原产物的影响如图所示。温度在200~1000℃范围里,要保证还原产物始终为ZnO和Fe3O4 , 则控制体系中CO的体积分数的范围为 。
