 C . 丙酸的结构简式:CH3CH2CH2COOH
D . 聚乙烯的链节:—CH2-CH2—
C . 丙酸的结构简式:CH3CH2CH2COOH
D . 聚乙烯的链节:—CH2-CH2—
物质 | 用途 | 性质 | |
A | 浓硫酸 | 实验室干燥气体 | 浓硫酸具有吸水性 |
B | 金属钠 | 用于冶炼钛、锆等金属 | 金属钠有强还原性 |
C | 二氧化硫 | 常用于漂白秸秆、织物 | |
D | 纯碱 | 用于清洗餐具 | 水溶液呈碱性 |




实验操作 | 现象 | 结论 | |
A | 取少量Fe(NO3)2溶液于试管中,滴入硫酸酸化的H2O2溶液 | 溶液由浅绿色变为黄色 | 氧化性:H2O2>Fe3+ |
B | 取2mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3溶液,充分反应后滴入5滴10%KSCN溶液 | 溶液变血红色 | KI与FeCl3反应有一定限度 |
C | 向Na2SiO3溶液中通入CO2气体 | 有白色沉淀生成 | 非金属性:C>Si |
D | 两只试管中均加入2mL0.1mol/L酸性KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/LH2C2O4溶液,比较溶液褪色的时间 | 加入0.2mol/LH2C2O4溶液的褪色时间更短 | 其它条件相同时,反应物浓度越大,反应速率越大 |
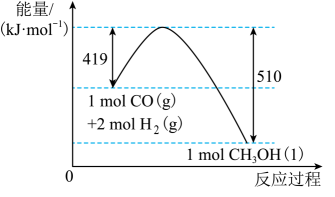


①从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是。
②可用热空气吹出溴是因为溴的(选填编号)
A.熔点较低 B.熔点较高 C.沸点较低 D.沸点较高

①灼烧海带至灰烬时所用的主要仪器名称是。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式。反应结束后,再加入作萃取剂,振荡、静置,该步操作用到的仪器名称为,可以观察到
层呈色。
①通过化学键的键能计算。已知:
化学键种类 | H-H | Cl-Cl | H-Cl |
键能(kJ/mol) | 436 | 247 | 434 |
计算可得:H2(g)+Cl2(g)=2HCl(g) △H= kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.2Na(s)+O2(g)=Na2O(s) △H=-414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:。
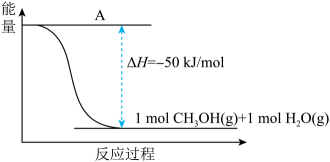
①补全上图:图中A处应填入。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H(填“变大”“变小”或“不变”)。
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
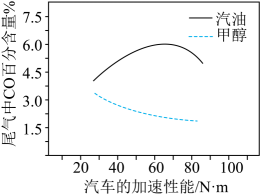
据图信息分析,与汽油相比,甲醇作为燃料的优点是。