|
|
|
|
A.PVC管道 | B.不锈钢管材 | C.钢化玻璃 | D.砂石 |

选项 | 劳动项目 | 化学知识 |
A | 学农活动:用厨余垃圾制肥料 | 厨余垃圾含N、P、K等元素 |
B | 社区服务:宣传推广使用84消毒液 | 84消毒液呈碱性 |
C | 帮厨活动:检验食盐是否加碘 | 食盐中的碘为KI |
D | 工厂实践:向食品包装袋内充氮气 | 氮气的密度接近空气 |


选项 | 实验操作 | 现象 | 结论 |
A | 向NaBr溶液中滴加足量氯水,再加入淀粉-KI溶液 | 溶液先变橙色,后变蓝色 | 氧化性:Cl2>Br2>I2 |
B | 向乙醇中加入一小粒金属钠 | 产生无色气体 | 乙醇中含有水 |
C | 将Fe3O4溶于稀硫酸,再滴入KMnO4溶液 | 溶液紫色褪去 | Fe3O4中含有Fe2+ |
D | 向Ca(ClO)2溶液中通入SO2气体 | 有沉淀生成 | 酸性:H2SO3>HClO |
![]()



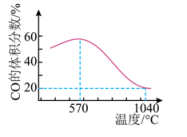
反应Ⅰ:Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH1>0
反应Ⅱ:Fe3O4(s)+4CO(g) = 3Fe(s)+4CO2(g) ΔH2
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO
的体积分数随温度的变化关系如图所示。下列说法正确的是
 ( )
( )
Ⅰ 制取氯酸钾
利用如图1所示的实验装置进行实验。回答下列问题:


图1 图2
装置C中盛装NaOH溶液仪器的名称是。在不同条件下KClO3可将KI氧化为I2或KIO3。室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1 KI /mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s) /g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1 H2SO4 /mL | 0 | 3.0 | x | 9.0 |
蒸馏水 /mL | 9.0 | 6.0 | 4.0 | 0 |
取少量反应后溶液滴加淀粉溶液 | 无现象 | 变蓝 | 变蓝 | 无现象 |
①3号试管实验中x的值为;1号试管实验的作用是。
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为。
③由该系列实验可得出的结论是。
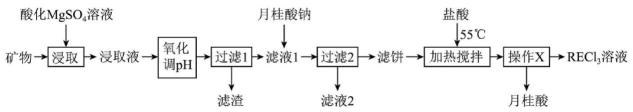
已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和(C11H23COO)3RE均难溶于水;该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.6×10-8;Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 | Mg2+ | Fe3+ | Al3+ | RE3+ |
开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
沉淀完全时的pH | / | 3.2 | 4.7 | / |

已知:①显示屏玻璃中含较多的SiO2、CeO2、FeO、Fe2O3及少量其他可溶于酸的物质;
②CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
ⅰ.相对分子质量比C大14
ⅱ.苯环上只有两个取代基