|
|
|
|
该图为实验室制取氨气的装置 | 实验室用该图装置制备氢氧化铁胶体 | 碱式滴定管排气操作,排气后记录初始读数 | 验证非金属性: |
A | B | C | D |


下列说法不正确的是( )

已知:极区发生的变化视为按两步进行,其中第二步为
(未配平)。下列说法错误的是( )
物质的量 | 0 | 2 | 4 | 6 | 8 | 10 |
4.8 | 2.64 | 1.8 | 1.8 | 2.1 | 2.1 | |
0 | 1.08 | 1.5 | 1.5 | 1.75 | 1.75 |
下列说法不正确的是( )
【实验一】制备无水氯化铬
反应原理为:。相关实验装置如图(夹持装置略)
已知:①的沸点是
。 ②
有毒,遇水发生水解反应。

实验的主要操作步骤有:a.水浴加热并维持的温度在
b.点燃处酒精喷灯,使瓷舟温度升至
左右,反应一定时间
c.打开 , 通入
并保证锥形瓶中每分钟有250个左右的气泡逸出
d.一段时间后停止通入
e.先后停止加热A、B,冷却,并继续通入一段时间的

向所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后通入水蒸气将氨气全部蒸出,将氨气用
溶液完全吸收,剩余的硫酸用
溶液恰好中和,则所得产品中氮化铬的纯度为.
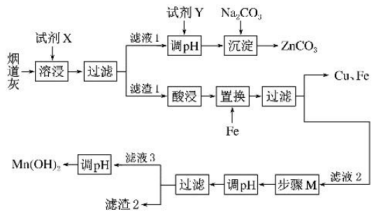
已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示.
金属离子 | |||
开始沉淀的 | 7.0 | 1.9 | 8.1 |
完全沉淀的 | 9.0 | 3.2 | 10.1 |
②的化学性质与
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数
与
的关系如图所示。
回答下列问题:
石墨电极反应式为.

①
②
相关物质的化学键键能数据如下:
化学键 | |||||
703 | 355 | 465 | 516 | 583 |
试计算该反应.
①可用、
、
、
表示该反应的平衡常数,其表达式为
;
②已知:上述反应的平衡常数的对数随温度的变化如图所示,在温度为
时此反应在
点达到平衡。若升高温度,B、C、D、E四点中能正确表示该反应的
与
的关系的点为.

0 | 10 | 20 | |
2.5 | 1.5 | 1.3 |
①内,用
来表示的平均化学反应速率为;
②在此温度下,于恒容密闭容器中充入进行此反应,能说明该反应已达到化学平衡状态的是(填字母)
a.
b.和
的浓度之比保持不变
c.在绝热容器中,反应的平衡常数不再变化
d.容器内气体的平均相对分子质量为45,且保持不变

①遇氯化铁溶液发生显色反应;②能发生水解反应;③苯环上只有两个取代基。
其中,核磁共振氢谱显示4组峰,且峰的面积之比为3∶2∶2∶1的结构简式为(写一种即可)。
 和乙酸为原料制备
和乙酸为原料制备 的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)