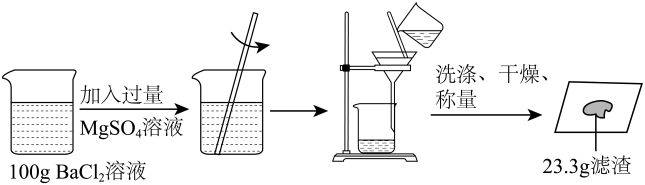
 B . 称取NaCl
B . 称取NaCl C . 读取液体体积
C . 读取液体体积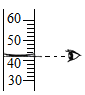 D . 溶解NaCl
D . 溶解NaCl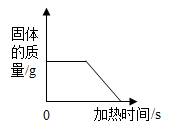

A.t2℃时,甲物质的溶解度为50
B.随温度升高,溶解度减小的物质是丙
C.P点表示t1℃时,甲、乙两种物质的溶解度相等
D.若甲的饱和溶液中含有少量丙,提纯甲的方法是
选项 | 实验目的 | 实验方法 |
A | 鉴别石墨和木炭 | 取样,分别点燃,观察是否生成气体 |
B | 比较铁、银的金属活动性 | 取样,分别加入稀盐酸,观察现象 |
C | 除去CO2中混有的HCl气体 | 将气体通过足量氢氧化钠溶液 |
D | 除去氮气中的少量氧气 | 将气体缓缓通过 |
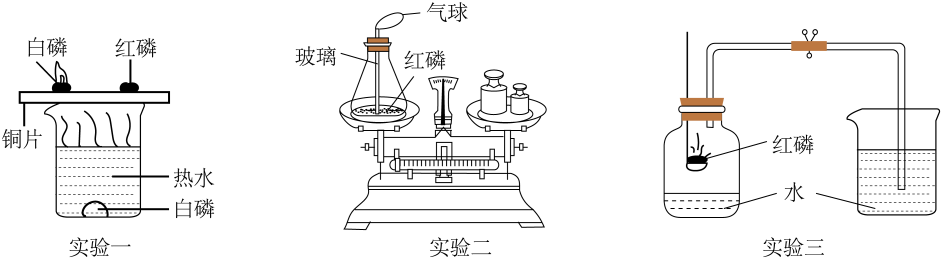
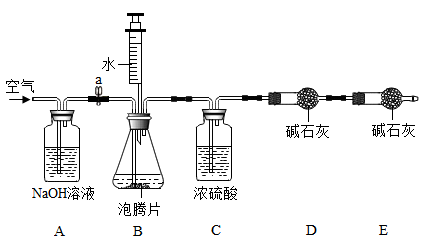
打开弹簧夹a,通入适量空气后,称量D装置,其质量为m1g。关闭弹簧夹a,用注射器向B装置中注入足量水。待B装置中无气泡产生后,打开弹簧夹,再次通入适量空气,第二次称量D装置,其质量为m2g。
①A装置中NaOH溶液的作用是。
②实验时,称取的泡腾片质量为4g,测定泡腾片中所含NaHCO3的质量分数为(用含m1、m2的代数式表示)。
【查阅资料】①金属钠性质活泼,常温下极易与氧气反应,生成白色物质氧化钠,氧化钠溶于水生成氢氧化钠;②Na2CO3溶液显碱尘。
【提出问题】生成的白色固体物质是什么?
【猜想与假设】猜想一:氧化钠;猜想二:碳酸钠;猜想三:。
【设计实验】
实验步骤 | 实验现象 | 实验结论 |
①取少量该样品于试管中,加入适量的水,振荡,过滤,向滤液中滴加无色酚酞溶液 | 溶液变成红色 | 白色物质中一定有氧化钠 |
②取少量该样品于试管中,滴加过量的稀盐酸 | 。 | 白色物质中一定有Na2CO3 |
由此同学们认为猜想三正确。
【交流与解释】在老师的指导下,通过讨论,同学们认识到由上述实验探究不能确定白色物质中一定有氧化钠,其理由是。
为了进一步确定白色物质中是否含有氧化钠,继续进行如下探究。
【继续探究】
实验步骤 | 实验现象 | 实验结论 |
①取少量该样品于试管中加入适量的水,振荡,过滤,向滤液中加入过量的CaCl2溶液,静置 | 。 | 白色物质中不含氧化钠 |
②取步骤①的上层清液于试管中,滴加无色酚酞溶液 | 。 |
通过上述探究,确定了猜想二成立。
【实验拓展】Na在CO2中燃烧的化学方程式为。