下列说法不正确的是( )
 B .
B . 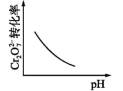 C .
C .  D .
D . 

下列有关说法不正确的是( )
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v | 0.080 | 0.161 | 0.239 | 0.159 | 0.241 |
选项 | 实验目的 | 方案设计 | 现象和结论 |
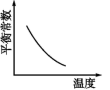
A | 探究温度对下列平衡的影响: | 取两支试管,分别加入2mL0.5mol/L的 | 加热时溶液变为黄色,置于冷水中后溶液由黄色变为蓝色。该正反应 |
B | 探究下列反应存在限度: | 在试管中入5mL0.1mol/L的KI溶液,然后向试管中滴加5~6滴0.1mol/L的 | 上层清液滴加KSCN溶液后,溶液呈血红色。该反应存在限度。 |
C | 探究 | 在试管中加入2mL0.5mol/L的 | 加入盐酸后,溶液由橙黄变为橙色。增大 |
D | 探究KI对 | 在试管中加入5mL碘水,加入1mL的 | 碘水加 |
②下列反应方程式正确的是。
A.少量的通入到NaClO溶液中:
B.往溶液中滴加少量
:
C.往溶液中滴加过量HCN:
D.往溶液中滴加HClO:
①称取样品ag,加水溶解,配制成100mL溶液。
②量取25.00mL溶液于锥形瓶中,用标准溶液进行滴定(还原产物为
),滴定至终点时消耗
溶液VmL。
a.用标准溶液润洗2至3次 b.记录起始读数
c.调整标准液液面至零刻度或零刻度以下 d.装入标准液至碱式滴定管零刻度以上
e.装入标准液至酸式滴定管零刻度以上 f.用溶液润洗2至3次
①
②
③
分解联产
、硫磺的热化学方程式为。

①制备的反应方程式:;
②制备过程中或
中任何一种超过理想条件比例,均会导致
产率下降,导致产率下降的原因是。
①写出氧化NO的化学反应方程式。
②当浓度一定时,NO的脱除效率与温度的关系如图所示。升温至80℃以上,NO的脱除效率提高主要有两方面原因,一方面是:大量汽化的
吸附在催化剂表面,分解产生高浓度的
, 加快反应速率;另一方面是:;温度高于180℃,NO的脱除效率降低的原因是。


在323K,向的
溶液中通入烟气,反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | |||||
c(mol/L) |
①溶液吸收NO的主要反应的离子方程式:。
②下列有关溶液吸收法处理烟气的说法不正确。
A.升高反应温度,一定有利于提高烟气中NO和的吸收效率
B.溶液吸收
的离子方程式可表示为:
C.随着吸收反应的进行,吸收剂溶液的pH会逐渐变大
D.数据说明NO吸收效率低于 , 可能原因是NO溶解度比
小