① ②
的体积分数不再变化 ③容器内气体压强不再变化
④键断裂的同时,有
键断裂 ⑤混合气体的体积不再变化
酸 | HA | HB | HC |
电离常数K |
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时 | 1.5 | 1.5 | 1 |
化学平衡常数 |
下列说法正确的是( ).
则
。
实验 序号 | 实验温度/K |
|
| 溶液颜色褪至无色时所需时间/s | |||
A | 293 | 2 | 0.02 | 5 | 0.1 | 5 | |
B | 2 | 0.02 | 4 | 0.1 | 8 | ||
C | 313 | 2 | 0.02 | 0.1 | 6 | ||
X | Y | Z | Q | |
起始/mol | 1.2 | 0 | ||
| 0.8 | 2.7 | 0.8 | 2.7 |
| 0.8 |
已知内
,
。
Ⅰ.
Ⅱ.
在恒容密闭容器进行反应Ⅰ,测得其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
A. B.容器内
的体积分数保持不变
C.容器内气体密度保持不变 D.容器中压强保持不变
③图甲、图乙分别表示反应在时刻达到平衡,在
时刻因改变某个条件而发生变化的情况。图甲中
时刻发生改变的条件是,图乙中
时刻发生改变的条件是。

A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.用待测定的溶液润洗酸式滴定管
D.用酸式滴定管取稀盐酸 , 注入锥形瓶中,加入酚酞溶液
E.取下碱式滴定管,用标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上
处,再把碱式滴定管固定好,并排出尖嘴部分的气泡,调节液面至“0”刻度或“0刻度以下,记下滴定管液面所在刻度
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
0.另取锥形瓶,再重复操作2~3次
完成以下填空。

滴定次数 | 待测盐酸体积(mL) | 标准 | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.60 | x |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
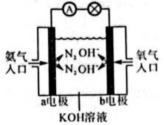
该电池负极的电极反应式为。
29℃时,如果溶液测得混合溶液的
。回答以下问题:
A. B.
C.
D.