
化学式 | 电离常数 |
HClO | |
编号 | ① | ② | ③ | ④ |
溶液 | 氨水 | NaOH溶液 | 氢氟酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
②配制溶液时需向溶液中加少量的(填化学式)以抑制水解。

冰醋酸稀释过程,溶液导电能力变化如图所示,则a、b、c三点对应溶液中,醋酸电离程度由大到小的顺序是(填字母)。用湿润的pH试纸测定b点pH,结果(填“偏大”、“偏小”或“准确”)。
25℃时,用pH计测定不同浓度醋酸溶液的pH,结果如下:
序号 | ① | ② | ③ | ④ | ⑤ |
醋酸浓度(mol/L) | 0.0010 | 0.01000 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
根据表中数据,稀释醋酸溶液,电离平衡(填“正”或“逆”)向移动;结合表中数据得出判断理由是
构建模型可帮助理解问题。盐酸和醋酸的“冰山”理解模型如下图,回答问题:

①模型1表示的是(填序号)。
A.等浓度的盐酸和醋酸 B.等pH的盐酸和醋酸溶液
②等体积,pH均为1的盐酸和醋酸溶液,中和NaOH的能力比较:盐酸.醋酸(填“>”、“<”或“=”)。
③模型2表示的两种溶液中分别加水,醋酸溶液中,
(填“增大”、“减小”或“不变”)
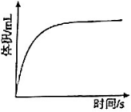
④过量镁粉分别与2mL 2mol/L盐酸、2mL 2mol/L醋酸溶液反应,测得铁粉与盐酸反应生成气体体积随时间变化如图,在图中画出镁粉与醋酸溶液反应的图像。
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴甲基橙指示剂;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测体积(mL) | 消耗盐酸标准的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |

甲 乙 丙
a.滴定前用蒸馏水冲洗锥形瓶
b.酸式滴定管滴至终点时,俯视读数
c.酸式滴定管用蒸馏水洗后,未用标准液润洗
d.酸式滴定管尖嘴部分有气泡,滴定后消失
回答下列问题:
Ⅰ.已知NO和经反应Ⅰ和反应Ⅱ转化为
, 其能量变化如图所示:

Ⅰ.
, 平衡常数
;
Ⅱ.____ , 平衡常数
;
a.升高温度 b.缩小容器体积 c.加入催化剂

T/℃ | 200 | 300 | 400 |
K | 0.5 |
请回答下列问题:
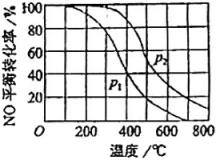
试比较、
的大小,
(填“>”、“=”或“<”)。

①随压强增大,的体积分数增大的原因是。
②比较b点和a点:平衡常数
(填“>”、“=”或“<”,下同),
的浓度
。
③计算b点的平衡常数(用分压表示的平衡常数,结果保留2位有效数字)