 C . 倾倒试剂
C . 倾倒试剂 D . 稀释浓硫酸
D . 稀释浓硫酸
| 选项 | 操作 | 目的 |
| A | 将一小片pH试纸湿润后放在玻璃上,用玻璃棒蘸取溶液滴在pH试纸上 | 测定某溶液的pH |
| B | 制取蒸馏水时,应加入几粒沸石(或碎瓷片) | 防止加热时出现暴沸 |
| C | 先将胶头滴管挤压,再伸入试剂中吸取液体 | 保证滴管的胶头部分也充满液体 |
| D | 将水沿烧杯壁缓慢地注入盛有浓硫酸的烧杯里,并用玻璃棒不断搅拌 | 稀释浓硫酸 |
![]()
 B .
B .  C .
C .  D .
D . 

小丽认为:通常状况下,1体积的水约能溶解1体积二氧化碳,因此上述实验不足以证明二氧化碳和氢氧化钠发生了反应。

①澄清石灰水②氢氧化钠浓溶液③稀盐酸④水
上述实验中,CO气体起到以下四个作用:
①作为反应物;
②实验开始时,先排尽装置中的空气,防止;
③停止加热后,继续通入气体,防止;
④类似鼓气装置的作用,能将反应中生成的CO2全部赶入NaOH溶液中,提高实验的准确性;

A | B | C | D | E |
|
|
|
|
|
|
①A、B、C、D、E五种物质中属于有机物的是(填序号)。
②太阳远紫外辐射能穿透上层大气到达低空,使D物质发生分解反应,生成B物质和氧气,该反应的化学方程式为。
③在一定条件下,3.4gC物质和4.8g氧气恰好完全反应,生成5.4gD物质和另一种物质,则该物质是(填序号)。
A.N2 B.NO C.NO2 D.N2O5

A、根据上述现象可知,该液体燃料的组成中含有
B、该同学认为通过上述现象不能确认燃料中是否含有氧元素.理由是.
C、为进一步确定该液体燃料的组成.现取5.6克该燃料充分燃烧,得到17.6g二氧化碳和7.2g水.由此可推知该液体燃料的化学式为.

图中字母A至G均表示装置编号。请根据实验装置,回答下列问题:
①提出假设:该反应的气体产物全部是二氧化碳。
②设计方案:将一定量的氧化铁在隔绝氧气条件下与过量炭粉完全反应(如图),测定参加反应的碳元素与氧元素的质量比。
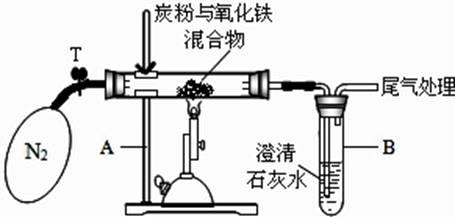
③查阅资料:氮气不与碳、氧化铁发生反应,可用来隔绝氧气。
④实验操作:
Ⅰ称取 3.2g 氧化铁与 2g 碳粉均匀混合,放入 48.48g 的玻璃管中,按如图装置连接;
Ⅱ加热前,先通一段时间纯净、干燥的氮气,其目的是;
Ⅲ夹紧 T 处弹簧夹,加热一段时间,澄清石灰水变浑浊;
Ⅳ完全反应后,冷却至室温,称得玻璃管和固体的总质量为 52.24g。
⑤数据处理:经计算,参加反应的碳元素质量为 0.48g,氧元素质量为 0.96g。
⑥得到结论:根据数据处理结果,得出原假设不成立,理由是。
硫酸镁 | 硫酸铜 | |
现象 | 无现象 | 有红色物质析出 |
由以上实验可知三种金属的活动性顺序是。
物质 | 镁与冷水 | 镁与水蒸气 | 铁与冷水 | 铁与水蒸气 | 铜与冷水 | 铜与水蒸气 |
反应情况 | 缓慢反应 | 不反应 | 能反应 | 不反应 | 不反应 |
根据金属活动性顺序和表中的信息,判断“镁与水蒸气”的反应情况为。
A.不反应B.缓慢反应C.比镁与冷水反应快D.比铁与水蒸气反应快
实验次数 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
1 | 10 | 7.5 |
2 | 10 | 5.0 |
3 | 10 | 3.2 |
4 | 10 | a |
根据实验数据计算:
