一、选择题(本大题共15小题,每小题3分,共45分。每小题只有1个选项符合题意。请将符合题意的选项用2B铅笔填涂在答题卡相应位置。)
-
A . 挂灯笼
B . 剪窗花
C . 打雪仗
D . 放鞭炮
-
A . 检查气密性 B . 倾倒液体
B . 倾倒液体 C . 用塞橡胶塞住试管
C . 用塞橡胶塞住试管 D . 过滤
D . 过滤
-
A . 氧气用于呼吸——氧气有氧化性
B . 二氧化碳灭火——二氧化碳能与水反应
C . 氮气作保护气——氮气的化学性质不活泼
D . 一氧化碳用于冶金工业——一氧化碳有还原性
-
A . 注射器中的气体通过压缩体积会变小——加压时气体分子体积变小
B . 金刚石和石墨的物理性质不同——碳原子的排列方式不同
C . 氧气和液氧都能支持燃烧——同种分子的化学性质相同
D . 酒香不怕巷子深——分子在不断地运动
-
A . 红磷在空气中燃烧产生大量白雾
B . 木炭在空气中燃烧,发红光,产生二氧化碳
C . 镁条在空气中燃烧发出耀眼的白光,放热,生成白色固体
D . 将铁钉放入到硫酸铜溶液中,铁钉表面有银白色物质生成,溶液由蓝色变为无色
-
6.
(2023九上·岳麓月考)
在探索生命起源的活动中,科学家发现将甲烷、氢气、氨气和水蒸气等混合气体放置在密闭容器中,在放电条件下会生成多种氨基酸。下列说法正确的是( )
A . 有新元素产生
B . 发生了化学变化
C . 元素的化合价没有改变
D . 密闭容器中原子的总数减少
-
A . O2
B . CO2
C . H2SO4
D . KMnO4
-
8.
(2023九上·岳麓月考)
钙元素被称为人体中的“白色钢筋混凝土”。钙元素在周期表中的信息及原子结构示意图如图。下列说法正确的是( )

A . 钙原子的核外电子数为2
B . 钙原子的结构示意图中x=10
C . 钙离子的符号为Ca+2
D . 钙元素位于元素周期表的第四周期
-
A . 碳酸钙的相对分子质量为100g
B . 碳酸钙中钙、氧元素的质量比为1:3
C . 碳酸钙中钙元素的质量分数为40%
D . 服用2片这种钙片,可摄入2.5g钙元素
-
A . 该反应中分子的种类改变、原子的种类不变
B . 氢气和氧气在点燃条件下生成水.
C . 每2个氢分子和1个氧分子在点燃条件下生成2个水分子
D . 2g氢气和lg氧气在点燃的条件下生成2g水
-
11.
(2023九上·岳麓月考)
地球上有丰富的水资源,通过电解水可以得到氢气和氧气。科学家一直在研究成本低、效率高的催化剂,使水分解。下列说法不正确的是( )
A . 电解水负极产生的气体是氢气
B . 电解水产生氢气和氧气的质量比约为1:2
C . 电解水常加入硫酸钠或氢氧化钠以增强导电性
D . 化学反应前后,催化剂的化学性质和质量不发生改变
-
A . 大力植树造林,保护环境
B . 禁用农药化肥,保护水源
C . 鼓励乘私家车,方便出行
D . 发展火力发电,缓解电荒
-
A . 地壳中含量最高的金属元素是铁
B . 生活中“低钠盐”“高钙奶”中的“钠”和“钙”是指金属单质
C . 钢的性能优良,所以钢是很纯的铁
D . 合金的硬度一般比组成它们的纯金属更高,抗腐蚀性能更好
-
A . 点燃
B . 通过足量的澄清石灰水
C . 通过足量的灼热氧化铜
D . 通过足量的水
-
A . 离子是带电的微粒,所以带电的微粒一定是离子
B . 同种元素的质子数相同,所以质子数相同的微粒一定属于同种元素
C . 化合物由不同种元素组成,所以由同种元素组成的物质一定不是化合物
D . 化学反应常伴随着能量的变化,所以有能量变化的反应一定是化学变化
二、填空题(本大题共4小题,化学方程式每个3分,其余每空2分,共20分。)
-
16.
(2023九上·岳麓月考)
阅读下列材料,回答有关问题:.
镁是一种年轻的金属,1808年英国化学家戴维用电解法最早制得镁。镁呈银白色,熔点为649℃,质轻、密度为1.74g/cm3。镁的化学性质活泼,能与许多物质发生化学反应,镁在氧气中燃烧生成氧化镁,镁在氮气中燃烧生成氮化镁(Mg3N2),镁在二氧化碳中燃烧生成碳和氧化镁。工业上主要利用电解熔融的氯化镁制取金属镁,同时生成氯气。人们常把镁称为“国防金属”,除照明弹里有镁粉外,燃烧弹里也装有镁粉,飞机的外壳常用铝镁合金制成。
-
(1)
请依据材料描述镁的物理性质(答一点即可)。
-
-
-
-
(2)
用澄清石灰水(主要成分是Ca(OH)2)检验二氧化碳。
-
-
(1)
常用的净水机一般有4道滤芯,如图。

活性炭在净水过程中主要起作用。RO反渗透膜能除去水中细菌、病毒以及钙离子、镁离子等多种金属离子,RO反渗透膜(填“能”或“不能”)降低水的硬度。
-
(2)
水基型灭火器是家庭常用灭火器。它产生的泡沫喷射在可燃物表面形成一层水膜,达到灭火的目的,其主要的灭火原理是。
-
-
(1)
以上碳单质中,由分子构成的物质的化学式是。
-
(2)
石墨烯是从石墨中分离出的单层石墨片,也是由碳原子构成的单质。请推测石墨烯可能具有的一条化学性质。
三、情境分析题(本大题共2小题,化学方程式每个3分,其余每空2分,共11分。)
-
20.
(2023九上·岳麓月考)
我国古代将炉甘石(主要成分:ZnCO
3),赤铜矿(主要成分:Cu
2O)和木炭粉为原料制得黄铜(铜和锌的合金,外观似黄金),其生产流程如下:

反应Ⅰ: ;反应Ⅱ:
;反应Ⅱ: ;赤铜和木炭反应。
;赤铜和木炭反应。
-
-
-
(3)
写出反应Ⅱ中赤铜(主要成分:Cu2O)和木炭在高温下反应生成铜和二氧化碳的化学方程式。
-
21.
(2023九上·岳麓月考)
C-14是含有6个质子和8个中子的碳原子,通过宇宙射线撞击空气中的氮原子所产生。宇宙射线由宇宙天体发出的高能粒子组成,它们在撞击地球大气层时,跟空气中氮原子发生碰撞,氮原子就会“捕捉”一个中子,“释放”一个质子,变成了C-14原子。C-14具有放射性,经过约5730年,C-14会减少一半。再经过约5730年,又会减少一半,这个时间就是C-14的半衰期。科学家利用C-14来测定古代遗存物的“年龄”。大气中的C-14能与氧气发生反应,生成物先被植物吸收,后被动物纳入。只要植物或动物生存着,伴随新陈代谢,C-14就会在机体内保持一定的平衡。而当有机体死亡后,其组织内的C-14便以5730年的半衰期开始衰变并逐渐消失。对于任何含碳物质,只要测定剩余放射性C-14的含量,再结合其半衰期,就可推断出年代。请根据短文回答下列问题:
-
(1)
与作为相对原子质量标准的C-12原子相比,C-14原子结构上的不同是。
-
(2)
下列说法正确的是____(填字母)。
A . C-14原子属于碳元素
B . C-14原子比C-12原子的质量大
C . 只要测出C-14的半衰期就可推断古代遗存物的“年龄”
四、实验探究题(本大题共2小题,每空2分,共18分。)
-
-
-
(2)
实验室制取少量的二氧化碳,发生装置最好选择(填字母)。
-
(3)
用Ⅰ装置收集氢气时,气体应从端进入(填“a”或“b”)。
-
-
(1)
【实验一】
探究制取CO2药品。取等质量的大理石加入等量的酸中(杂质不与酸反应)。
实验编号 | 药品 | 实验现象 |
Ⅰ | 大理石粉末、稀盐酸 | 产生气泡,反应速率很快 |
Ⅱ | 块状大理石、稀硫酸 | 产生气泡,反应速率慢并逐渐停止 |
Ⅲ | 块状大理石、稀盐酸 | 产生气泡,反应速率适中 |
通过实验确定Ⅲ组的药品最适合用于实验室制取CO
2 , 理由是
。
-
(2)
【实验二】
探究CO2的收集方法。
如图分别用向上排空气法和排水法收集CO
2 , 装置Ⅰ中验满的方法是
。装置II中集气瓶口冒出大气泡则已集满。
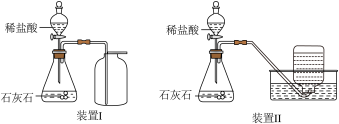
通过压强传感器测定不同方法收集得到的CO2纯度,获得数据如表。
-
(3)
通过以上实验,你对向上排空气法和排水法收集CO2的新认识是。
-
(4)
【实验三】
探究CO2的性质。
如图所示实验,①④为湿润的紫色石蕊试纸,②③为干燥的紫色石蕊试纸,用铜丝固定。通入CO
2后,紫色石蕊试纸最先变红的是
(填序号)。
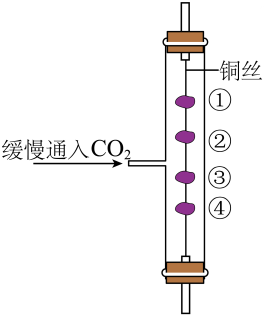
-
-
(6)
通入的CO2必须干燥,有同学提出可以用CaO作干燥剂,除去CO2中混有的水蒸气,你是否同意这个方案,请说明理由。
五、计算题(本大题共1个小题,第(1)问2分,第(2)问4分,共6分)
-
24.
(2023九上·岳麓月考)
工业上高温煅烧石灰石可得到二氧化碳

, 杂质不参与反应),某石灰石样品中碳酸钙的质量分数为80%,现有125kg该样品,请计算:
-
(1)
125kg该石灰石样品中碳酸钙的质量为kg。
-
(2)
煅烧125kg该石灰石,最多可以得到二氧化碳的质量为多少?(请写出计算过程。)
 B . 倾倒液体
B . 倾倒液体 C . 用塞橡胶塞住试管
C . 用塞橡胶塞住试管 D . 过滤
D . 过滤





;反应Ⅱ:
;赤铜和木炭反应。


