 D .
D . 
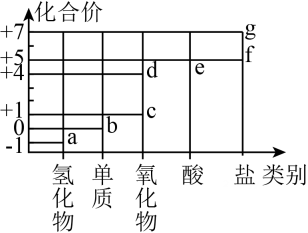

选项 | 实验操作和现象 | 结论 |
A | 向某溶液中滴加几滴新制氯水,再滴加少量KSCN溶液,溶液变红 | 溶液中含有Fe2+ |
B | 室温下,测得NaX和NaY溶液的pH分别为8和9 | 酸性:HX>HY |
C | 蔗糖溶液中加入少量稀硫酸,水浴加热5min,加氢氧化钠溶液至溶液呈碱性,再加入少量新制Cu(OH)2 , 继续加热5min,生成砖红色沉淀 | 蔗糖完全水解 |
D | 向等体积等浓度的稀硫酸中分别加入少量等物质的量的ZnS和CuS固体,ZnS溶解而CuS不溶解 | Ksp(ZnS)>Ksp(CuS) |

①拆卸前,将锂电池放电处理有利于锂在正极的回收,其原因是。
②石墨电极连接电源的极(填“正”或“负”)。
③结合电极反应,指出阴极室的pH变化并解释原因:。
第一步: ΔH>0
第二步: ΔH<0

Ⅱ. CO2加氢合成甲醇也是化学固碳的一种有效途径,不仅可以有效减少空气中的CO2排放,而且还能制备出甲醇清洁能源。反应如下:
主反应: ΔH1=-49 kJ⋅mol-1
副反应: ΔH2=+41kJ⋅mol-1
向刚性容器中充入投料比为1:3的CO2和H2 , 图二中横坐标为在催化剂TiO2条件下反应相同的时间,CO2转化率随温度升高而升高。纵坐标为在该时间内CH3OH选择性和CO选择性(CH3OH的选择性、CO的选择性
)随CO2转化率的变化。


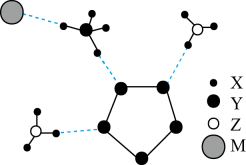
已知:
①[Co(NH3)6]2+具有较强还原性;溶液呈棕色
②。
回答下列问题:
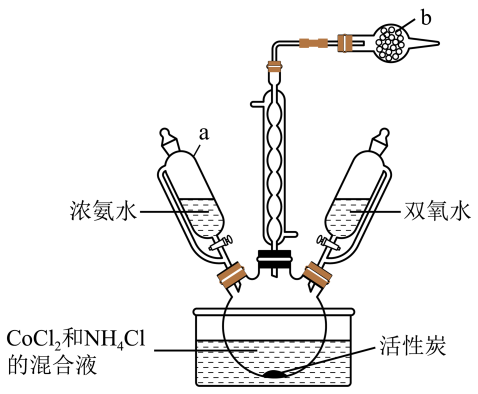
①蒸氨:取0.5000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热,蒸出的NH3通入含有V1mL c1mol·L-1 H2SO4标准溶液的锥形瓶中。
②滴定:用c2mol·L-1 NaOH溶液滴定剩余的H2SO4 , 消耗V2mL NaOH溶液。滴定时选用的指示剂为,NH3的质量分数为;
③误差分析:下列操作使得NH3的质量分数偏大的有。
A.用 H2SO4吸收NH3操作缓慢,导致部分NH3外溢到空气中
B.NaOH溶液使用前敞口放置于空气中一段时间
C.滴定后读数,先平视后俯视
D.滴定读数后,发现滴定管尖嘴处还悬有一滴氢氧化钠溶液
①打开和
, 通入
待E中出现时,再点燃酒精灯,此操作的目的是;②熄灭酒精灯;③冷却到室温;④关闭
和
.
①钠块表面变黑,熔融成金属小球;
②继续加热,钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和白色固体产生.
③F中试管内壁有黑色固体生成
实验探究Ⅰ:探究硬质玻璃管中固体产物中钠元素的存在形式
假设一:白色固体是;假设二:白色固体是
;假设三:白色固体是
和
的混合物.请完成下列实验设计,验证上述假设;
步骤1:将硬质玻璃管中的固体产物溶于水后,过滤;
步骤2:往步骤1所得滤液中加入足量的溶液产生白色沉淀,过滤;
步骤3:往步骤2所得滤液中滴加几滴酚酞试液,滤液不变红色.
结论:假设一成立.
实验探究Ⅱ:钠与二氧化碳反应产物中碳元素的存在形式.
实验说明:钠与二氧化碳反应的产物中除了碳酸钠以外,还有存在(填化学式)