选项 | A | B | C | D |
生活中 的化学 |
树林中的丁达尔效应 |
维生素C片 |
节日烟火 |
氢氧化钠片 |
化学原理 (或用途) | 树林中存在分散质粒子直径介于1 nm~100 nm的分散系 | 能将人体中摄取的不易吸收的铁离子转化为易吸收的亚铁离子,是因其具有还原性 | 属于金属元素的焰色试验 | 常用来治疗胃酸过多 |
选项 | 陈述 | 解释 |
A | NaHCO3用于治疗胃酸过多 | NaHCO3可与盐酸反应 |
B | 向Na2O2与H2O反应后的溶液中滴入MgCl2溶液,产生白色沉淀 | Na2O2与水反应生成氢氧化钠,OH-与Mg2+反应生成Mg(OH)2 |
C | 金属钠应保存在煤油中隔绝空气 | 常温下,金属钠露置在空气中会生成过氧化钠 |
D | 过氧化钠可用作航天员的供氧剂 |
|


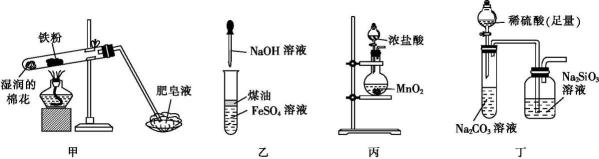

选项 | 实验操作 | 现象 | 结论 |
A | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液 | 溶液颜色变红 | 溶液X含有Fe3+ |
B | 向饱和的Na2CO3溶液通入CO2 | 产生白色沉淀 | 溶解度:NaHCO3<Na2CO3 |
C | 向Fe2O3、CuO、Fe的混合粉末中加入过量稀盐酸 | 析出红色固体 | 反应后溶液中阳离子只有H+和Fe2+ |
D | 向煮沸的NaOH溶液中滴入几滴饱和FeCl3溶液,继续加热 | 溶液变成红褐色 | 制得Fe(OH)3胶体 |
已知:氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl- , 在75℃以上和浓碱溶液中主要产物是ClO3-和Cl-

回答下列问题:
在NaBr和KSCN的混合溶液中滴加少量(CN)2 , 请写出发生反应的离子方程式。
I.上述反应的还原剂是
II.根据上述反应,鉴别某白色固体是NaNO2还是NaCl。可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉溶液 ④白酒 ⑤食醋(稀的醋酸溶液),你认为必须选用的物质有(填字母)。
A .③⑤ B.①②⑤ C.①②④
III.某厂废液中,含有2%~5%的NaNO2直接排放会造成污染,下列试剂能使NaNO2转化为N2防止污染的是。(填字母)
A.NaCl B. C.
D.浓
ⅰ.当汽车发生较严重的碰撞时,引发分解
, 从而为气囊充气。产生的Na立即与
发生置换反应生成
, 化学方程式是。
ⅱ.是冷却剂,吸收产气过程释放的热量。
起冷却作用时发生反应的化学方程式为。
ⅲ.一个安全气囊通常装有 , 其完全分解所释放的
为mol。(保留两位小数)

已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入从而把熔点降至约580℃。
①把NaCl固体加热至熔融状态,目的是。
②粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是。
(填离子符号)