将2滴0.1 mol/L 溶液滴入2 mL 0.1 mol/L NaCl溶液中,观察到生成白色沉淀。
振荡试管,然后向其中滴加4滴0.1mol/L KI溶液,静置。观察到沉淀变为黄色。
下列关于上述实验的分析错误的是( )
1. 40mL0.03mol·L-1的HCl溶液
2. 50mL0.03mol·L-1的AgNO3溶液
3. 30mL0.02mol·L-1的CaCl2溶液
4. 10mL蒸馏水
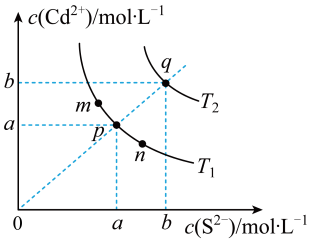
AgCl的溶解度由大到小的顺序是____。


Cu(OH)2的溶度积Ksp=3×10-20 , 通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1 ,
银电极:;
X电极:。
酸 | 电离平衡常数 |
醋酸 | K=1.75× 10-5 |
碳酸 | K1=4.5×10-7 K2=4.7×10-11 |
亚硫酸 | K1=1.4×10-2 K2=6.0×10-8 |
其水解程度增大的是____(填字母)。
HSO3—⇋H+SO32- Ka2 , HSO3-+H2O ⇋H2SO3+OH- Kh2
已知25℃时,Ka2>Kh2 , 则0.1mol/L NaHSO3溶液:
①溶液呈(填“酸性”“碱性”或“中性”)。
②溶液中 c(Na+)c(HSO3-)。(填“>”“<”或“=”)
Ⅰ.用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液(装置如图),某次滴定前、后盛放盐酸的滴定管中液面的位置。

待测NaOH溶液体积(mL) | 标准盐酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | |
10.00 | 0.40 | 20.50 |
10.00 | 2.10 | 24.20 |
10.00 | 4.10 | 24.00 |
a.锥形瓶用待测液润洗
b.滴定前滴定管尖嘴部分有气泡,滴定结束时气泡消失
c.滴定过程中锥形瓶中溶液溅出瓶外
d.滴定结束时,俯视读数
①称取样品a g,加水溶解,配成100mL溶液
②取25.00mL溶液于锥形瓶中,用标准溶液(酸性)进行滴定,滴定终点时消耗标准溶液V mL。
向滴定管中注入标准溶液之前的一步操作为。
