编号 | A | B | C | D |
实验 方案 |
|
|
|
|
实验 目的 | 验证质量守恒定律 | 探究燃烧条件之一需要可燃物 | 探究铁钉生锈时O2是否参与反应 | 比较Zn和Fe的金属活动性强弱 |
①滤渣中一定含有锌
②滤渣中一定含有铜和铁,可能含有锌
③向滤渣中加入一定量稀盐酸, 最后溶液一定变成浅绿色
④滤液中溶质一定含有硫酸锌和硫酸镁
⑤滤液的颜色不可能为浅绿色
| | | | |
| A.向一定质量的二氧化 锰中加入过氧化氢溶液 | B.向等 质量的镁 粉和 铝粉中分别加入等浓度 的稀盐酸 | C.镁在氧气中燃烧 | D.向一定量铁粉和铜粉混 合物中加入硫酸铜溶液 |

I、Cu2O中铜元素的化合价是,1mol Cu2O中约含有个Cu原子。
II、反应的化学方程式:X+Cu2O+CZn+2Cu+2CO2↑。则炉甘石主要成分X的化学式是,根据产物可知黄铜中含有的金属是
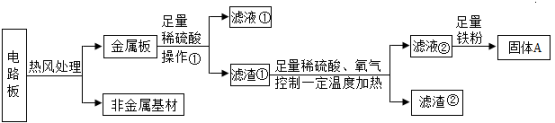
【查阅资料】在一定条件下能发生反应: , 而Au、Ag不能反应。
实验步骤 |
|
|
实验现象 | 无明显变化 | 。 |
实验结论 | 。 | |
【作出猜想】猜想一:滤渣中一定有铜,猜想二:。
实验步骤 | 实验现象 | 实验结论 |
向滤渣中加入20%稀硫酸 | 有气泡产生 | 猜想二正确 |
【交流讨论】
滤液中一定含有的溶质是(填化学式)。