选项 | 生活应用或生产活动 | 化学知识 |
A | 用SO2漂白纸张 | SO2具有氧化性 |
B | 用铝槽车运输浓硝酸 | Al在冷的浓硝酸中发生钝化 |
C | 用铁盐净水 | Fe3+水解得到Fe(OH)3胶体 |
D | 用热的纯碱溶液清洗铁屑油污 | 油脂在碱性条件下可水解 |

元素 | 相关信息 |
X | 原子核外有6种不同运动状态的电子 |
Y | 基态原子中s电子总数与p电子总数相等 |
Z | 原子半径在同周期元素中最大 |
M | 逐级电离能(kJ•mol-1)依次为578、1817、2745、11575、14830、18376 |
Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
L | 基态原子核外有四个电子层,最外层只有一个电子,其它电子层均排满电子 |
请用化学用语填空:

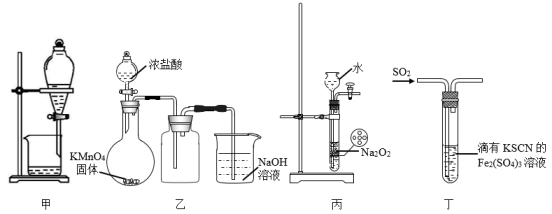
①利用装置A制取实验所需的氨气,写出反应的化学方程式:。
②该实验中用浓盐酸与MnO2反应制取所需氯气,装置B中盛放浓盐酸的仪器名称是,写出该反应的离子方程式:。则装置E中用于除气体杂质的试剂是(填写试剂名称)
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序
a→d→c→→ ←j←i←h←g←b
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要 、 等两种;岩脑砂的主要成分中所含化学键的类型、、
氨气和氯气反应生成N2的化学方程式是。
①黄砷结构与白磷相似,黄砷的空间构型为,第三周期,第一电离能介于Al和P之间的元素有种。
②近年来,黑砷在催化电解水方面的研究受到关注,其晶体结构与石墨类似。根据图中信息,下列说法正确的有(填标号)。

a.黑砷中As—As键的键能均相同
b.黑砷与C60都属于混合型晶体
c.黑砷单层中As原子与As—As键的个数比为2:3
d.黑砷层与层之间的作用力为范德华力
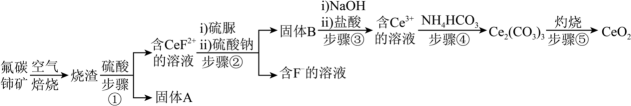
已知:①Ce3+可形成难溶于水的复盐[(Ce2(SO4)3·Na2SO4·nH2O],其氢氧化物也难溶于水。
②硫脲的结构简式为CS(NH2)2 , 在酸条件下易被氧化为(CSN2H3)2。
请回答:

滴定过程中,接近终点时需采用半滴操作,具体操作是:慢慢旋转滴定管旋塞,使滴定管口悬挂液滴而不滴落,用靠落液滴,并用将液滴冲入溶液中,振荡锥形瓶使溶液充分混合。
