 B . 阿伏加德罗常数约为6.02×1023mol-1
C . Na+的摩尔质量是23g
D . NaHSO4在水中的电离方程式:NaHSO4=Na++ H++SO
B . 阿伏加德罗常数约为6.02×1023mol-1
C . Na+的摩尔质量是23g
D . NaHSO4在水中的电离方程式:NaHSO4=Na++ H++SO


序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
③ | O2 | H2 | 通过灼热的氧化铜 |
④ | NaCl固体 | CaCO3 | 溶解,过滤、蒸发 |
I 新疆也要建造磁悬浮列车了。在磁悬浮列车制造过程中将使用大量含钇(Y)元素的超导材料。钇(Y)元素在元素周期表中的信息如图所示:

①CO2 ②Al ③乙醇 ④Fe(OH)3胶体 ⑤熔融BaSO4 ⑥KOH溶液 ⑦固态
上述物质中属于电解质的是。(填序号)
84消毒液 有效成分NaClO 规格1000mL 质量分数 14.9% 密度1.19g/cm3 |
①需要用量筒量取mL上述浓硫酸进行配制。
②配制上述稀硫酸,除量筒、胶头滴管、烧杯、玻璃棒外,还缺少的玻璃仪器是。
③在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是(填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.往容量瓶转移时,有少液体溅出
e.未洗涤稀释浓硫酸的烧杯
①孔雀石与稀盐酸
②溶液A与H2O2
③溶液B与CuO
④CO2与NH3•H2O、CaCl2溶液
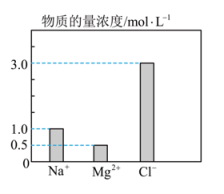
①该混合液中的物质的量为mol。
②将该混合液加水稀释至体积为1L,稀释后溶液中的物质的量浓度为。
③向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀mol。