 C . 质量数为37的氯原子:
C . 质量数为37的氯原子:
| 酸 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | H2SO4 | NaOH | BaCO3 | CO | CO2 |
B | HNO3 | KOH | NaHCO3 | CaO | SO2 |
C | CH3COOH | Cu2(OH)2CO3 | CaCl2 | Na2O | SO3 |
D | NaHSO4 | NH3 | NaCl | CuO | NO2 |
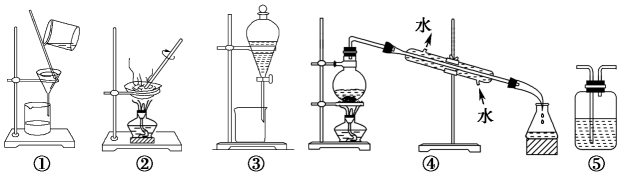
![]()

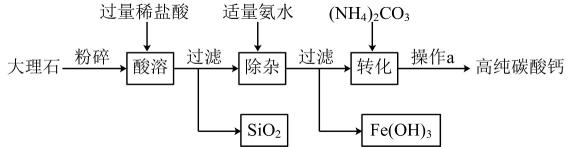
CO、SO
、NO
。现进行如下实验:
①用红色石蕊试纸检验,试纸变蓝色。
②另取少量溶液逐滴滴加盐酸至过量,有气体放出,再加入BaCl2溶液后,没有沉淀生成。
③另取少量溶液用足量硝酸酸化后,加入AgNO3溶液有白色沉淀生成。
根据上述实验推断:原溶液中肯定含有的离子是( )
元素编号 | 元素性质或原子结构的相关叙述 |
T | 失去一个电子后形成与Ne相同的核外电子排布 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
Z | 原子核外有3个电子层,最外层比次外层少1个电子 |

请回答下列问题:

该混合液中的物质的量为mol,将该混合液加水稀释至体积为1L,稀释后溶液中
的物质的量浓度为
。
