
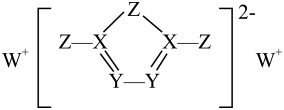

已知![]() 是类似于苯的芳香族化合物。下列说法错误的是( )
是类似于苯的芳香族化合物。下列说法错误的是( )
A | B | C | D |
|
|
|
|
模拟侯氏制碱法获得 | 制备 | 测定未知 | 配制 |
 的速率决定
的速率决定

反应Ⅰ:
反应Ⅱ:
在密闭容器中通入和
, 假设只发生反应Ⅰ和Ⅱ,分别在
和
下进行反应,其中
和
的平衡体积分数随温度变化如图所示。
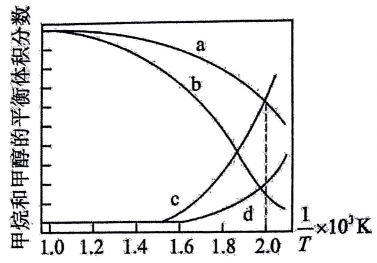
已知:对于反应Ⅱ,为速率常数,只与温度有关,分压
总压
物质的量分数。下列说法不正确的是( )
金属离子 | |||||
开始沉淀的 | 1.5 | 3.0 | 8.9 | 6.0 | 8.1 |
完全沉淀的 | 2.8 | 4.7 | 10.9 | 8.0 | 10.1 |
“中和”步骤要调节溶液 , 最适宜的
范围是.

A.前 , 主要发生的反应是
下降较慢
B. , 主要发生的反应是
,
下降较快
C.之后,
趋于稳定,则
已完全氧化
D.后,继续通入空气,可能将产品氧化生成
及
, 使产品中锰含量下降
步骤1:准确称取 , 先与
脱氯剂
溶液混合,加入氨水至
下搅拌
可得前驱体(
(难溶于水),反应装置如图所示(加热装置已略去);
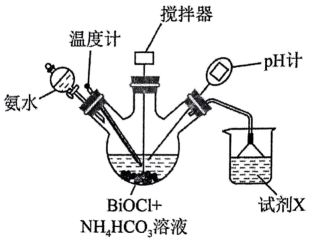
步骤2:将前驱体干燥后灼烧,可得。
回答下列问题:
①分离前驱体的操作名称是;盛装标准溶液应选用(填“酸式”或“碱式”)滴定管。
②若消耗标准液的平均体积为
的摩尔质量为
, 则脱氯率为
(用含
的代数式表示)。

①与
能形成配位键的原因是.
②由以上事实可判断中心原子杂化方式肯定不是
杂化,判断理由是.
③铂可溶于王水,王水中含有亚硝酰氯()。下列说法正确的是.
A.均为强电解质
B.分子中
键和
键的个数比为
C.是极性分子
D.为直线形分子
(ⅰ)
(ⅱ)
①下列有关溶液的说法正确的有.
A.加入少量水稀释,溶液中离子总数增加
B.加入少量硫酸,溶液的pH不变
C.加入少量固体,平衡时
与
的比值保持不变
D.加入少量溶液,反应(ⅰ)的平衡逆向移动
②时,
溶液中
随
的变化关系如图。
当时,设
与
的平衡浓度分别为
, 则
之间的关系式为
;计算溶液中
的平衡浓度(结果保留两位有效数字)。


反应炉中的反应:
催化转化器中的反应:
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:(数值保留小数点后一位)。


①在约时,有无
催化,其转化率几乎相等,是因为.
②在压强、温度
催化条件下,将
按照物质的量比为
混合,发生热分解反应
平衡产率为
。掺入
能提高
的平衡产率,解释说明该事实,平衡常数
(以分压表示,分压
总压
物质的量分数)
电离平衡常数 | ||
纯碱溶液吸收少量的离子方程式为.