A | B | C | D |
|
|
|
|
过滤 | 渗析 | 蒸发 | 丁达尔效应 |
| 陈述Ⅰ | 陈述Ⅱ | 判断 |
A |
|
| Ⅰ对,Ⅱ对,有 |
B | 用洁净的铂丝蘸取某溶液进行焰色试验,火焰为黄色 | 该溶液一定是钠盐的溶液 | Ⅰ对,Ⅱ对,有 |
C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
D | 过氧化钠可为航天员供氧 |
| Ⅰ对,Ⅱ对,有 |
加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI•淀粉溶液 |
实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 得到蓝色溶液 |
则下列说法错误的是( )
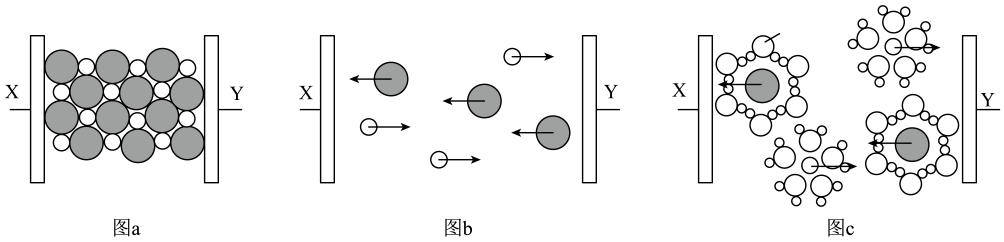
 代表的是水合钠离子
B . 氯化钠只有在通电条件下才能电离
C . 图b表示熔融状态下氯化钠的导电过程
D . 氯化钠在不同状态下均能导电
代表的是水合钠离子
B . 氯化钠只有在通电条件下才能电离
C . 图b表示熔融状态下氯化钠的导电过程
D . 氯化钠在不同状态下均能导电
①标准状况下,水中含有
个水分子
②常温常压下,含有的分子数约为
③的摩尔质量为
④的气体摩尔体积约为
⑤标准状况下,由
和
组成的混合气体中,所含氮原子的物质的量为
⑥的
溶液中
的数目为
⑦常温常压下,氦气含有的原子数为
①纯碱去油污
②明矾可以净水
③醋酸作为调味剂
④铜锈的主要成分为
⑤可以杀菌
上述涉及的物质成分中,属于弱电解质的有(填写化学式),写出其电离方程式。
干法制备:
先制备得到 , 反应为
, 该反应中,氧化剂是,氧化产物是。

称取一定质量的待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的 , 然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的
, 然后取下干燥管称得其质量为
。
①洗气瓶b中盛放的液体是(写名称)。
②锥形瓶中发生反应的离子方程式为。
③第二次通入的目的是。如果没有进行第一次通
操作,测量的结果将会(填“偏大”“偏小”或“不变”)。
④甲同学设计的实验装置中存在一不合理之处,会导致测定结果出现误差。如何改进?。

乙同学测得样品中的质量分数为(用含x和y的代数式表示)
I.配制溶液的实验步骤如下:
a.计算需要氢氧化钠固体的质量
b.用滤纸称量氢氧化钠固体;
c.用适量的蒸馏水溶解称量好的氢氧化钠固体,直接注入容量瓶;
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
e.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切:
f.盖好瓶塞,反复上下颠倒,摇匀;
g.将配制好的溶液倒入试剂瓶中,并贴好标签。
下图所示的仪器中,配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器有烧杯、玻璃棒和(填仪器名称)。
现用质量分数为98%、密度为的浓硫酸来配制500mL、
的稀硫酸。计算所需浓硫酸的体积为mL(保留1位小数),现有①10mL②25mL③50mL④100mL四种规格的量筒,你选用的量筒是(填代号)。