①逐滴加入NaOH溶液,有白色沉淀生成,继续滴加至过量,沉淀部分溶解。
②加足量BaCl2溶液,产生白色沉淀,再向沉淀中加入过量稀盐酸,沉淀质量不变。
下列说法错误的是( )
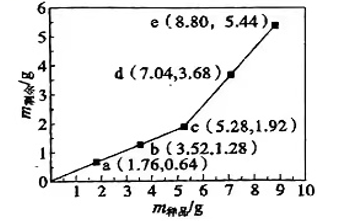
实验 | 0.1 mol.L-1酸性KMnO4溶液的体积/mL | 0.6mol.L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
1 | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
表中V1=mL。
探究温度对化学反应速率影响的实验编号是(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是。
实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=mol·L-1·min-1。
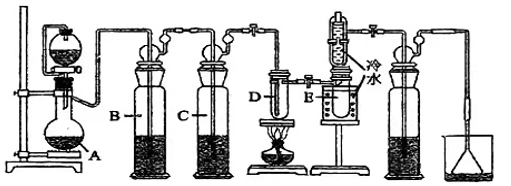
【相关药品性质】
药品 | 颜色、状态 | 熔点(℃) | 沸点(℃) | 其他性质 |
Sn | 银白色固体 | 231 | 2260 | 较活泼金属能与O2、HCl等气体发生反应 |
SnCl4 | 无色液体 | -33 | 114 | 极易水解产生SnO2.xH2O溶胶 |
请回答下列问题:
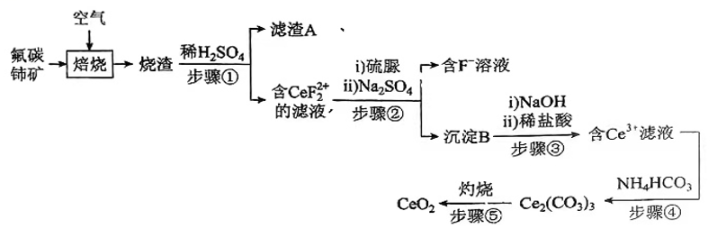
已知:①稀土离子易与SO42-形成复盐沉淀,Ce3+和SO42-发生反应:;
②硫脲:具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+ , 两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题: