反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
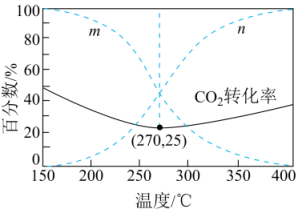
在5MPa下,按照投料,平衡时,CO和
在含碳产物中物质的量分数及
的转化率随温度的变化如图。下列说法正确的是( )
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是( )
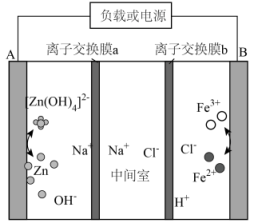
| 实验目的 | 方案设计 | 现象和结论 |
A | 探究反应物浓度对化学反应速率的影响 | 分别取10mL0.1mol/LNa2S2O3溶液和5mL0.1mol/LNa2S2O3溶液、5mL蒸馏水于两支试管中,然后同时加入10mL0.1mol/LH2SO4溶液 | 前者出现浑浊的时间更短,说明增大Na2S2O3浓度,可以加快反应速率 |
B | 探究压强对化学反应速率的影响 | 在容积不变的密闭容器中发生反应:N2(g)+3H2(g) | 反应速率不变,说明化学反应速率不受压强影响 |
C | 探究温度对化学平衡的影响 | 将装有NO2和N2O4混合气体的连同球分别浸泡在冰水和热水中:2NO2(g)(红棕色) | 热水中气体颜色深,冰水中颜色浅,说明其他条件不变时,升高温度,会使化学平衡向吸热方向移动 |
D | 探究KI与FeCl3反应的限度 | 取5mL0.1mol/L的KI溶液于试管中,加入1mL0.1mol/L的FeCl3溶液,充分反应后滴入5滴15%KSCN溶液 | 溶液变血红色,则KI与FeCl3的反应有一定限度 |
①基态的价层电子排布式为。
②Li、P、O三种元素的电负性由大到小的顺序是。
①根据价层电子对互斥理论可知,的空间结构为。
②比较S原子和O原子的第一电离能大小,并从原子结构的角度说明理由:。
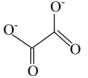 , 其中碳原子的杂化轨道类型为。
, 其中碳原子的杂化轨道类型为。
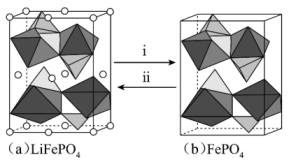
①i表示(填“充电”或“放电”)过程。
②已知Li+的脱嵌率=。某时刻,若正极材料中Li+的脱嵌率为
, 则其中
。
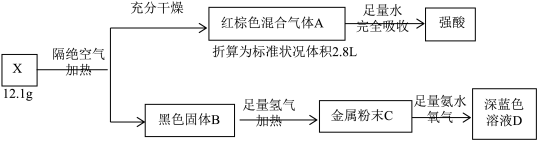
已知:黑色固体B用100mL2.0 mol/L H2SO4溶液溶解后,多余的酸用0.30 mol NaOH恰好中和。
①结合图1,从平衡移动的角度分析,通入Ar的作用是。
②若要将的平衡转化率提高到60%,则
。
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高的转化率
②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是。
t℃ | 丙烷转化率 | 产物的选择性 | ||
CO | ||||
400 | 4.06 | 93.12 | 2.20 | 4.68 |
500 | 12.32 | 91.23 | 3.16 | 5.61 |
600 | 35.22 | 85.44 | 7.73 | 6.83 |
下列说法不正确的是____。

已知:①具有强氧化性,②沉淀Ⅰ中只含有两种沉淀,③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | |||||
开始沉淀 | 27 | 7.6 | 7.6 | 4.0 | 7.7 |
沉淀完全 | 3.7 | 9.6 | 9.2 | 5.1 | 9.8 |
温度范围/℃ | 150~210 | 290~320 | 890~920 |
固体质量/g | 4.41 | 2.41 | 2.25 |
经测定,210~290℃过程中产生的气体只有 , 此过程发生反应的化学方程式是。
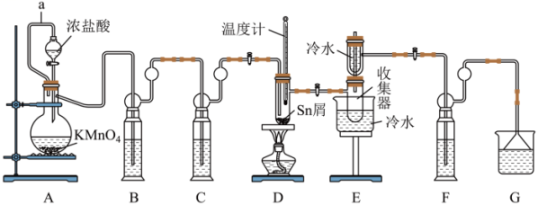
已知:①熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成
),且熔融Sn与
反应生成
时放出大量的热。
②Sn熔点为232℃,无水熔点为246℃、沸点为652℃。
回答下列问题:
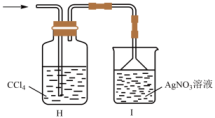
乙同学认为,不能确定进入装置I的气体只有一种,为证明最终进入装置I的气体只有一种,乙同学提出再加一个装置,即可完成论证。请给出改进方案:。