
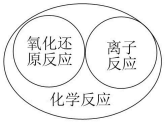
 D .
D . 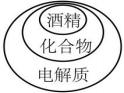
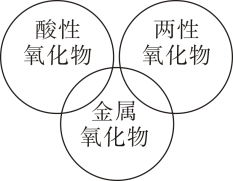
 D .
D . ①酸性氧化物一定是非金属氧化物
②、
都能溶于水生成碱,它们都属于碱性氧化物
③和
互为同素异形体
④、
、
、
均可通过化合反应制得
⑤已知: , 则
不是电解质
⑥冰中水分子间以氢键结合成排列规整的晶体,体积膨胀密度减小,所以冰浮在水面上
下列说法正确的是( )。
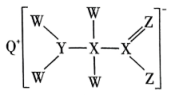
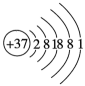
①根据元素周期律,下列推断正确的是(填序号)。
A.M的最高正化合价为价 B.
的还原性比
强
C.最高价氧化物的水化物的酸性:M>W D.稳定性:
②在一定条件下可与
溶液反应,生成一种正盐和水,该正盐化学式为。(用含M的化学式表示)
巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是与
反应产生
促进藻类快速生长。当有
生成时(标准状况下),反应中转移电子为mol。
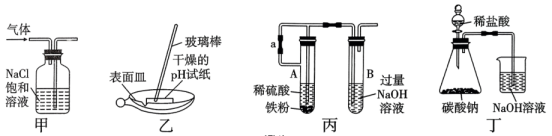
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为670℃,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

①对比氯化铁中铁元素的质量分数为34.46%,说明含有杂质。
②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是。
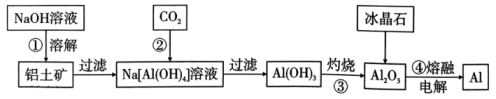
②高温氧化时反应的化学方程式为。
③上述流程中的作用是。
④操作a由两种均发生了化学反应的过程构成,其内容分别是、铝与铬的氧化物反应。
①写出在酸性条件下被
还原为
的离子方程式:。
②若处理含(不考虑其他含铬微粒)的污水时恰好消耗
, 则当铁铬氧体中
时,铁铬氧体的化学式为。