
选项 | 实验 | 现象 | 结论 |
A | 用 | 试纸最终显蓝色 |
|
B | 向盛有 | 先产生白色沉淀,然后白色沉淀转化为黄色沉淀 | |
C | 向 | 溶液褪色 |
|
D | 向 | 产生白色沉淀 | 气体X一定具有强氧化性 |

①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是,浓硫酸的作用是,a试管中主要反应的化学方程式为.
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是.
①;②
;③
.
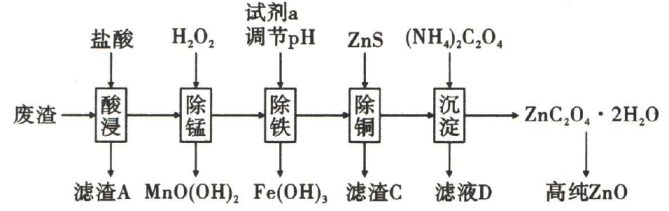
已知:①草酸受热易分解生成
;
②常温下: .

下列说法正确的是____(填序号).

电极b是电解池的极,电极反应式为.
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取盐酸 , 注入锥形瓶中,加入酚酞作指示剂
D.另取锥形瓶,再重复操作次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上
处,调节液面至“0”刻度或“0”刻度以下,再把碱式滴定管固定好
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定时正确的操作顺序是(填序号)E→→F→→C→→D.
②上述滴定操作用到的仪器有(填序号).

③滴定时边滴边摇动锥形瓶,眼睛应注意观察.滴定终点溶液颜色的变化是.
④滴定结果如下表所示:
滴定次数 | 待测液体积/ | 标准溶液的体积/ | |
滴定前读数 | 滴定后读数 | ||
1 | 20.00 | 1.03 | 23.03 |
2 | 20.00 | 0.60 | 22.60 |
3 | 20.00 | 0.20 | 20.19 |
则该盐酸浓度为 .
⑤若碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准溶液,则测定结果将(填“偏高”“偏低”或“不变”).