
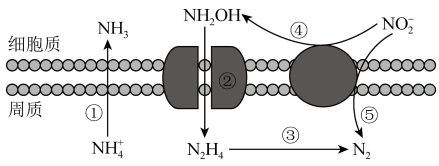
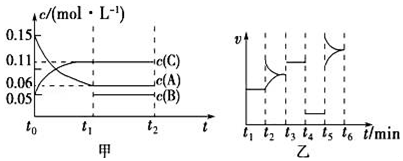
①一个N≡N键断裂的同时,有6个N﹣H键断裂
②v(N2)=0.2mol•L﹣1•min﹣1 , v(NH3)=0.4mol•L﹣1•min﹣1
③保持其他条件不变时,体系压强不再改变;
④恒温恒容时,混合气体的密度保持不变;
⑤NH3、N2、H2的体积分数都不再改变.
①NaHB═Na++HB﹣
②HB﹣⇌H++B2﹣
③HB﹣+H2O⇌H2B+OH﹣且常温下溶液中c(H+)>10﹣7mol•L﹣1 .
下列说法一定正确的是( )
C(石墨)+O2(g)═CO2(g)△H=﹣393.51kJ•mol﹣1
C(金刚石)+O2(g)═CO2(g)△H=﹣395.41kJ•mol﹣1
关于金刚石和石墨的相互转化,下列说法正确的是( )
①CO(g)O2(g)═CO2(g)△H=﹣283.0kJ•mol﹣1
②S(s)+O2(g)=SO2(g)△H=﹣296.0kJ/mol﹣1
则CO、SO2转化为单质S的热化学方程式是。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣547kJ/mol﹣1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H1=?
若1 mol CH4还原NO2至N2的过程中放出的热量为867kJ,则△H2=
a.主族元素 b.副族元素 c.Ⅷ族元素 d.过渡元素

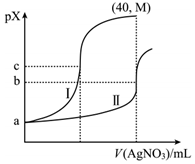
①用离子方程式表示Na2CrO4溶液中的转化反应。
②由图可知,溶液酸性增大,CrO42﹣的平衡转化率(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为。
③升高温度,溶液中CrO42﹣的平衡转化率减小,则该反应的△H0(填“>”“<”或“=”)。
①用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直至当 ____时,即确定达到滴定终点。
②若滴定开始和结束时,酸式滴定管中的液面如图1所示所用盐酸溶液的体积为 ____mL。

①用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直至当时,即确定达到滴定终点。
②若滴定开始和结束时,酸式滴定管中的液面如图1所示所用盐酸溶液的体积为 mL。

①T1T2(填“>”“<”“=”),T2时Ksp(BaSO4)=。
②根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是 (填字母)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线下方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是 (用编号填写)。
a.CH3COONa
b.Na2CO3
c.NaClO
d.NaHCO3
②常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填字母)。
A.c(H+)
B.
C.c(H+)•c(OH﹣)
D.
①用离子方程式表示该水溶液呈碱性的原因 。
②在该水溶液中各离子浓度的大小关系是 。