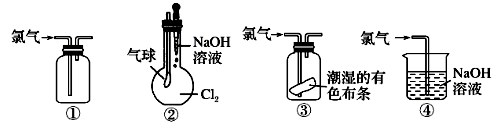
①可用于氯气的收集 ②若气球干瘪,证明Cl2可与NaOH反应 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
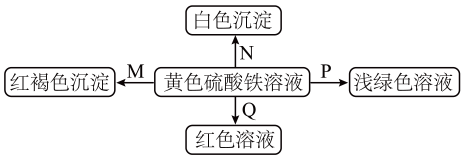
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | Zn | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | Fe | KSCN |
D | Na2O2 | MgCl2 | Fe | KSCN |
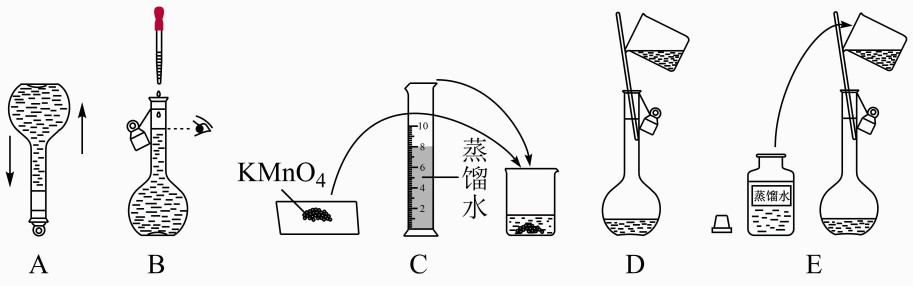
定容的操作是将蒸馏水注入容量瓶,当,改用胶头滴管加水至溶液凹液面与刻度线相切。
①转移溶液前,容量瓶底部有水
②转移溶液时,溶液不慎洒到容量瓶外
③定容时,俯视刻度线
④摇匀后,液面低于刻度线,再加水至凹液面与刻度线相切
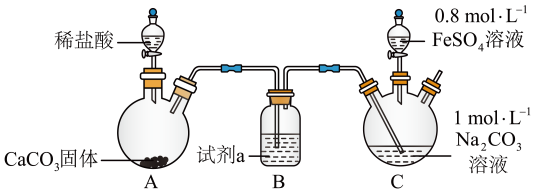
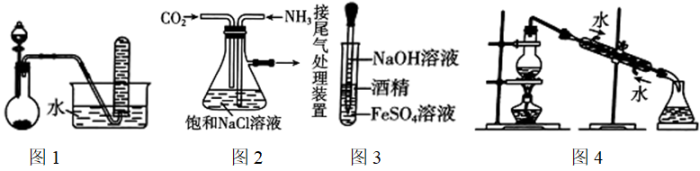
向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为。
②向碳酸钠溶液中通入CO2的目的有、。
③试剂a是,装置C中制取FeCO3的离子方程式为。
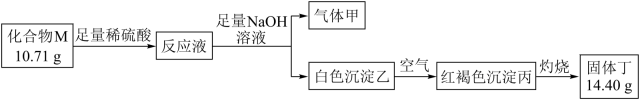
气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式。