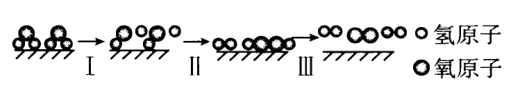
已知几种物质中化学键的键能如表所示:
化学键 | ||||
键能 | 463 | 496 | 436 | 138 |
若反应过程中分解了水,则下列说法不正确的是( )
资料1:室温下,过氧化氢溶液可与氢碘酸反应;
资料2:碘单质溶于水后,溶液为棕黄色.
资料3:实验数据见下表.
实验编号 |
|
| 蒸馏水 | 温度/ | ||
浓度 | 体积 | 浓度 | 体积 | 体积 | ||
Ⅰ | 0.1 | 1 | 0.1 | 1 | 8 | 25 |
Ⅱ | 0.1 | 1 | 0.1 | 1 | 40 | |
Ⅲ | 0.1 | 1 | 0.1 | 6 | 25 | |
下列说法正确的是( )
选项 | 生活现象 | 化学知识 |
小苏打作发酵剂 |
| |
纯碱溶液不能保存在玻璃塞的试剂瓶中 |
| |
|
| |
长期施用 |
|
|
|
|
|
A.锥形瓶使用前需用待测液醋酸润洗 | B.可用该滴定管量取一定体积的 | C.碱式滴定管滴定前要排气泡 | D.滴定前后滴定管读数方式如图所示,则测得的结果偏大 |
甲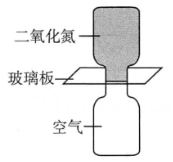 乙
乙
选项 | 现象预测 | 分析 |
A | 甲盛 |
|
B | 乙盛空气的集气瓶出现红棕色 | 熵增的方向是自发的 |
C | 经过足够长的时间,所有瓶中气体颜色相同 | 最终可以达到相同的平衡状态 |
D | 所有集气瓶中气体颜色均变深 | 反应 |
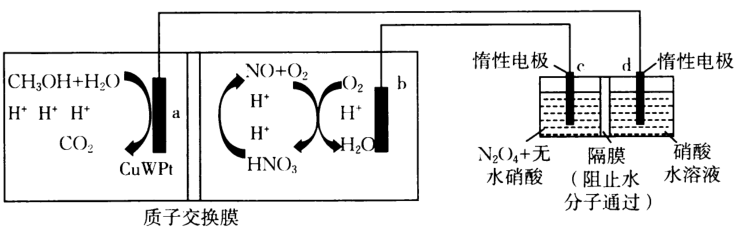
甲 乙
①酸性标准溶液滴定草酸溶液的离子方程式为;本实验(填“需要”或“不需要”)另加指示剂;如何判断滴定终点:.
②若消耗的酸性标准溶液为
, 则该血液样品中
的浓度为
.
③下列操作会使测得的血液样品中的浓度偏高的是.
A.滴定管未用标准溶液润洗 B.草酸钙沉淀洗涤不充分
C.滴定前仰视读数并记录数据 D.盛放草酸溶液的锥形瓶没有干燥
向三只比色血中加入酸性
标准溶液各
, 再向其中分别加入
稀硫酸各
, 然后再分别加入
的
溶液
, 通过手持色度计和数据采集器测定溶液透光率随时间的变化曲线如图1所示.

图1 相同浓度与相同浓度
溶液在不同酸度下的反应曲线
①由图1分析,你能得出的结论是.
②以稀硫酸的变化曲线为例.
前后曲线变化幅度不同的原因是.
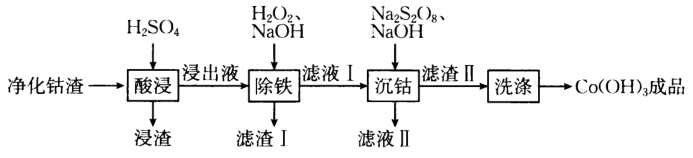
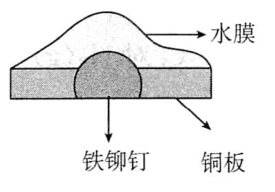
该工艺条件下,有关金属离子开始沉淀和沉淀完全的见下表:
金属离子 | |||
开始沉淀 | 1.9 | 7.5 | 7.7 |
沉淀完全 | 3.2 | 9.0 | 9.2 |
已知:一种离子的浓度时已沉淀完全;
的还原产物为
.
回答下列问题:
②
对于反应:③![]()
.
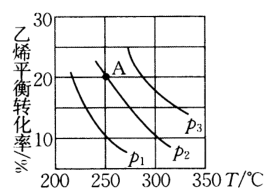
A.通入稀有气体 B.提高温度 C.增加环戊烯浓度 D.增加浓度
一定条件下,将与
置于恒容密闭容器中发生反应:
, 下列状态能说明该反应达到化学平衡的是____(填字母编号).

图1
图2 图3
图3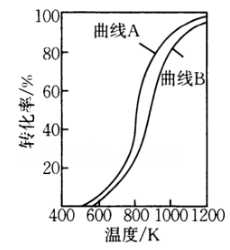
干重整反应的热化学方程式为(选用
的关系式表示反应热),反应Ⅱ是(填“慢反应”或“快反应”).