选项 | 实验操作和现象 | 结论 |
A | 向盛有饱和Na2S2O3溶液的试管中滴加稀盐酸,溶液变浑浊且有气体生成 | 说明生成了S和H2S |
B | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
C | 常温下,测得0.1 mol/LNaA溶液的pH大于0.1 mol/L Na2CO3溶液的pH | 酸性:HA<H2CO3 |
D | 向CuS的悬浊液中加入饱和MnSO4溶液可生成浅红色沉淀(MnS为浅红色) | 说明Ksp(MnS) < Ksp(CuS) |
①标准状况下,2.24 L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为NA
③电解精炼铜时,若阴极得到电子数为2NA , 则阳极质量减少64 g
④7 g CnH2n中含有的氢原子数为2NA
⑤常温下,7.1 g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
⑥1 L 2 mol·L-1的FeCl3溶液中含Fe3+数为2NA
⑦2 L 1 mol·L-1的盐酸中所含氯化氢分子数为2NA
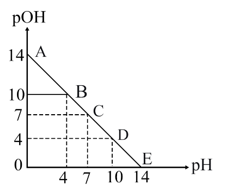
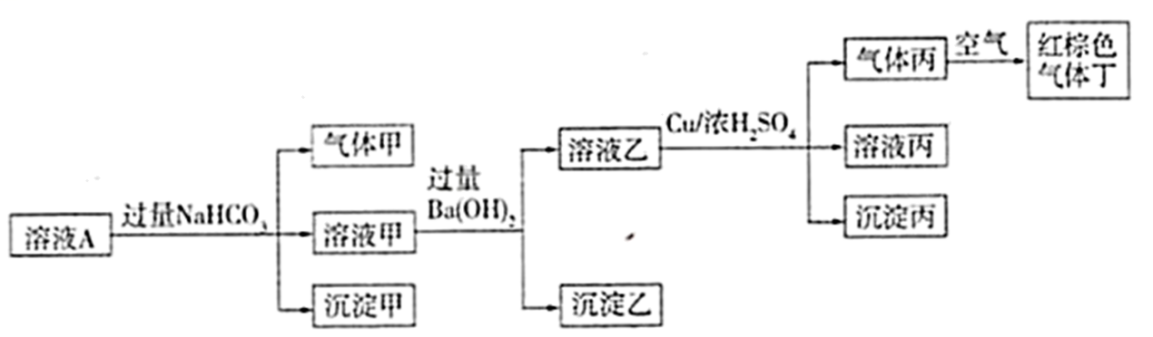
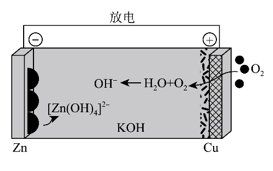
根据以上的实验操作与现象,下列有关说法不正确的是( )
实验 | 实验操作和现象 |
1 | 测得10mL0.1mol·L-1NaHC2O4溶液的pH约为5.5 |
2 | 向酸性KMnO4溶液中滴加过量0.1mol·L-1NaHC2O4溶液,溶液紫红色褪色 |
3 | 向0.1mol·L-1NaHC2O4溶液中加入等体积0.1mol·L-1Ba(OH)2溶液,溶液变浑浊 |
4 | 向10mL0.1mol·L-1NaHC2O4溶液中滴加少量0.1mol·L-1NaOH溶液,无明显现象 |
下列说法正确的是( )
①5秒内,v(NO2)=mol/(L·s);
②若将该容器置于冰水中,气体颜色将(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=。
HSO3-⇌H++SO32- Ka2
HSO3-+H2O⇌H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2 , 则0.1 mol/L NaHSO3溶液:
①溶液呈(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)c(HSO3-)(填“>”“<”或“=”)。
①几分钟后,可观察到导管中的水柱;
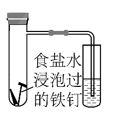
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为。
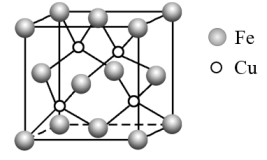
①目前测定晶体结构可靠的科学方法是。一种铜铁催化剂的晶胞如图所示,基态原子的电子排布式为,该晶胞中与一个
原子相紧邻的
原子有个。
②在光照和铜铁催化剂条件下,基态碳原子吸收能量变为激发态原子。下列3种不同状态的碳原子轨道表示式中,能量状态最高的是(填字母)。
a.
b.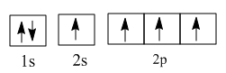
c.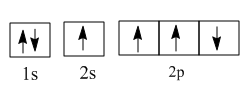

①已知Ti元素的电负性为1.5,O元素的电负性为3.5,则、O原子之间通过键形成稳定的化合物。
②电极表面生成异丙醇的电极反应式为,此电极反应需选用高活性和高选择性的电化学催化剂,其目的是。
①从反应条件考虑,影响FeCl3水解平衡的因素有(答两点)。
②取10mL 1mol/L的FeCl3溶液加水稀释,盐的水解程度(填“增大”、“减小”或“不变”)。
向500mL FeCl3溶液中加入65g锌粉,实现现象记录如下:
i.实验前期,溶液的pH逐渐增大,锌粉表面未发现气泡;
ⅱ.随着反应的进行,观察到瓶底产生红褐色沉淀,同时出现少量气泡;
ⅲ.15分钟后溶液中产生大量气泡;
ⅳ.……
①经实验确认“实验前期”溶液中有Fe2+生成,确认有Fe2+的实验操作和现象是,结合平衡移动原理解释:实验前期溶液pH增大的原因。
②查阅资料发现:Fe(OH)3常温下的溶度积常数为2.810-39 , 请写出Fe(OH)3的沉淀溶解平衡表达式,试从Ksp-Q关系角度结合具体数值分析反应开始c(H+)=0.2mol·L−1时,没有出现红褐色沉淀的原因。
③结合离子方程式解释反应过程中气泡变化的原因。
用c mol·L-1AgNO3标准溶液滴定反应后溶液中的Cl- , 采用K2CrO4为指示剂,利用Ag+与CrO生成砖红色沉淀指示滴定终点,实现操作如下:
i.以醋酸纤维滤膜过滤掉水样中的悬浮物,调节水样pH在6.5~10.5;
ⅱ.取10.00mL水样,加入K2CrO4溶液作指示剂,用AgNO3标准溶液滴定至终点,消耗AgNO3溶液VmL。
①滴定时,AgNO3标准溶液应加到(填玻璃仪器名称)中。
②锌和FeCl3溶液反应后溶液中Cl-浓度为(用含c的代数式表示)mol·L-1
③已知:Cr2O(黄色)+H2O
2H++2CrO
(橙色),解释滴定时调节水样pH在6.5~10.5的原因。