①反应速率5v(NH3)=4v(O2) ②体系的压强不再发生变化 ③混合气体的密度不再发生变化 ④气体的平均摩尔质量不再发生变化 ⑤单位时间内生成5 mol O2 , 同时断裂12 mol O—H键 ⑥NO的浓度不变
元素 | 元素性质或原子结构 |
原子核外 | |
在同周期元素中,原子半径最大 | |
电离能( | |
其价电子中,在不同形状的原子轨道中运动的电子数相等 | |
只有一个不成对电子 |

实验次数 | 第一次 | 第二次 | 第三次 |
消耗盐酸溶液体积/mL | 27.00 | 27.02 | 26.98 |
经计算,该纯碱样品的纯度为。
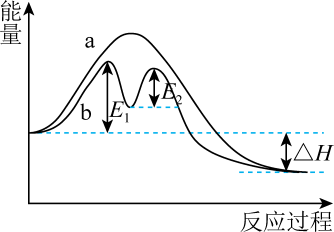
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
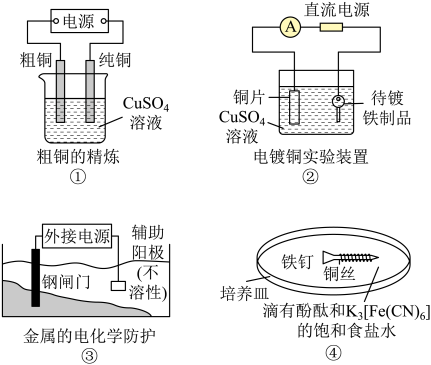
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
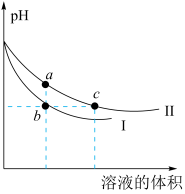
①T1℃,0~5min内,以CO2表示的该反应速率v(CO2)=,该条件下的平衡常数K=。
②第15 min后,温度调整到T2 , 数据变化如上表所示,则T1 T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=。