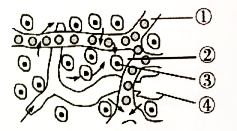


性染色体组成 | 外生殖器表现 | |
未做手术 | 手术后 | |
XY | 雄性 | 雌性 |
XX | 雌性 | 雌性 |

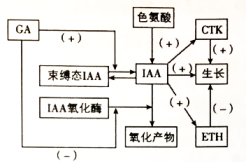
组别 | 处理 | 光合速率[mmol/(m2·s)] | 气孔导度[mmol/(m2·s)] | 胞间CO2浓度[mmol/(m2·s)] | Rubisco活性[μmol/(m2·s)] | 丙二醛(MDA)(μmol/g) |
① | 不遮光+清水 | 10.1 | 0.16 | 260 | 38.2 | 2.12 |
② | 不遮光+DA-6 | 15.2 | 0.24 | 255 | 42.1 | 1.93 |
③ | 遮光+清水 | 8.3 | 0.14 | 278 | 25.3 | 2.74 |
④ | 遮光+DA-6 | 13.4 | 0.23 | 269 | 35.7 | 2.39 |
(注:气孔导度表示气孔张开的程度;Rubisco是暗反应的关键酶;丙二醛是膜脂过氧化产物,其含量与生物膜受损程度呈正相关)




图1

图2

实验假设:生长素对脱落酸的功能有抑制作用(不考虑促进作用)。
实验方案:取若干长势相同、处于生殖生长末期的棉花植株,均分成甲、乙、丙三组,做如图所示的处理,观察三组植株叶片脱落的先后顺序。
预测三组植株的落叶顺序,得出实验结论:
①若则假设成立;
②若则假设不成立。
目前,美国的艾利森(James P.Allison)教授与日本的本庶佑(Tasuku Honjo)教授提出的癌症免疫治疗成为继手术、化疗、放疗后又一种新的治疗方式,两位科学家因此获得2018年诺贝尔生理学或医学奖。
癌细胞是发生了遗传变异等病理变化的自体细胞,由于表面物质发生改变可被T细胞识别并清除,也可能因此发生免疫逃逸。
基于T细胞的监控清除功能,为避免其失控攻击正常细胞,这种特异性免疫会受到严格控制。本次诺贝尔奖的“主角”——CTLA-4和PD-1(称为免疫系统的检查点),是防止T细胞失控的“刹车”。
CTLA-4是T细胞表面的一种膜蛋白,用于抑制T细胞的增殖。艾利森开发了一种可以与CTLA-4结合并抑制其作用的抗体,通过该抗体阻断CTLA-4从而松开T细胞的“刹车”,并促使自身的免疫系统重新攻击癌细胞。临床研究显示,该疗法对晚期黑色素瘤效果显著。
PD-1是T细胞表面的另一种膜蛋白。正常细胞表面存在相应的膜蛋白受体PD-L1,当PD-1和PD-L1识别并特异性结合时,T细胞就不会攻击该细胞。本庶佑教授的科研团队发现,很多癌细胞中PD-L1的表达量都有一定的上升,癌细胞表面的PD-L1在一定程度上会骗过T细胞的识别,降低被攻击的概率。
如同其他癌症治疗方法一样,基于免疫检查点的癌症免疫治疗也会引起一些副作用。随着现代生物医学技术研究与应用的不断深入与发展,将不断提升该疗法的治疗效果和改善不良反应的发生,实现人类长期抑制、甚至治愈癌症的梦想。
